ECMO اکمو یا اکسیژندهی غشایی خارج بدن ، نوعی دستگاه خارجی پشتیبان حیات است که در آن یک مسیر مصنوعی خارجی خون وریدی را از بیمار به یک دستگاه تبادل گاز (اکسیژناتور) انتقال میدهد ، که در آن خون با اکسیژن غنیسازی شده و گاز دی اکسید کربن از آن زدوده می شود ، سپس این خون به سیستم گردش خون بیمار ، بازگردانده میشود . مسیر جریان خون در اکمو ، برای فراهم آوردن پشتیبانی کافی از بیمار در شرایط عدم فعالیت قلب و ریه فرد بهینه ، میگردد .
Extra Corporeal Membrane Oxygenation

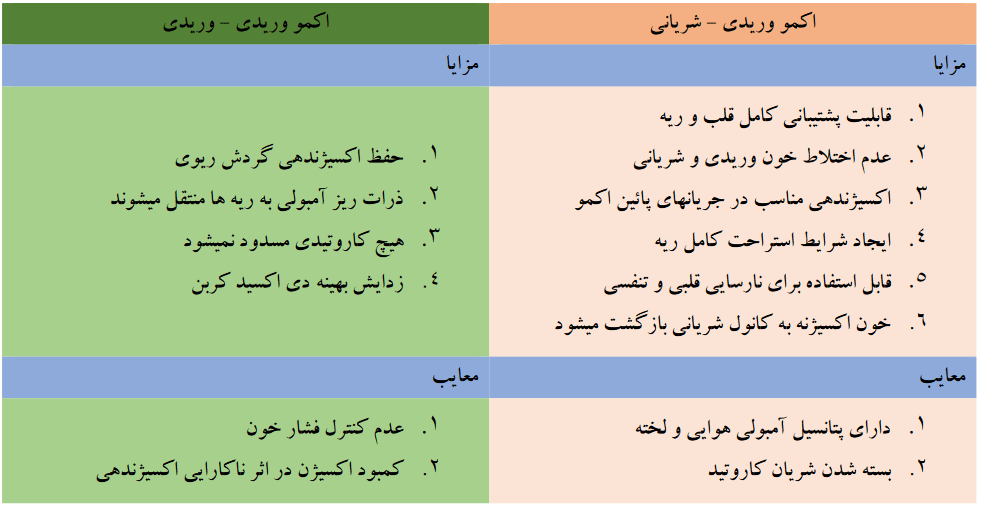
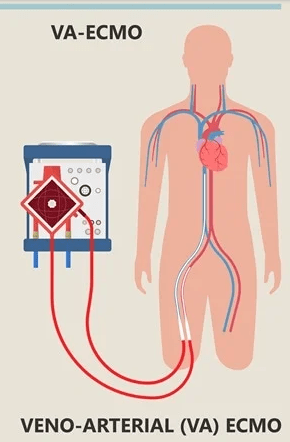
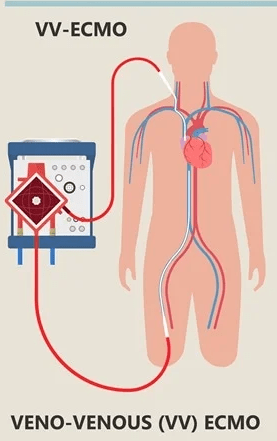
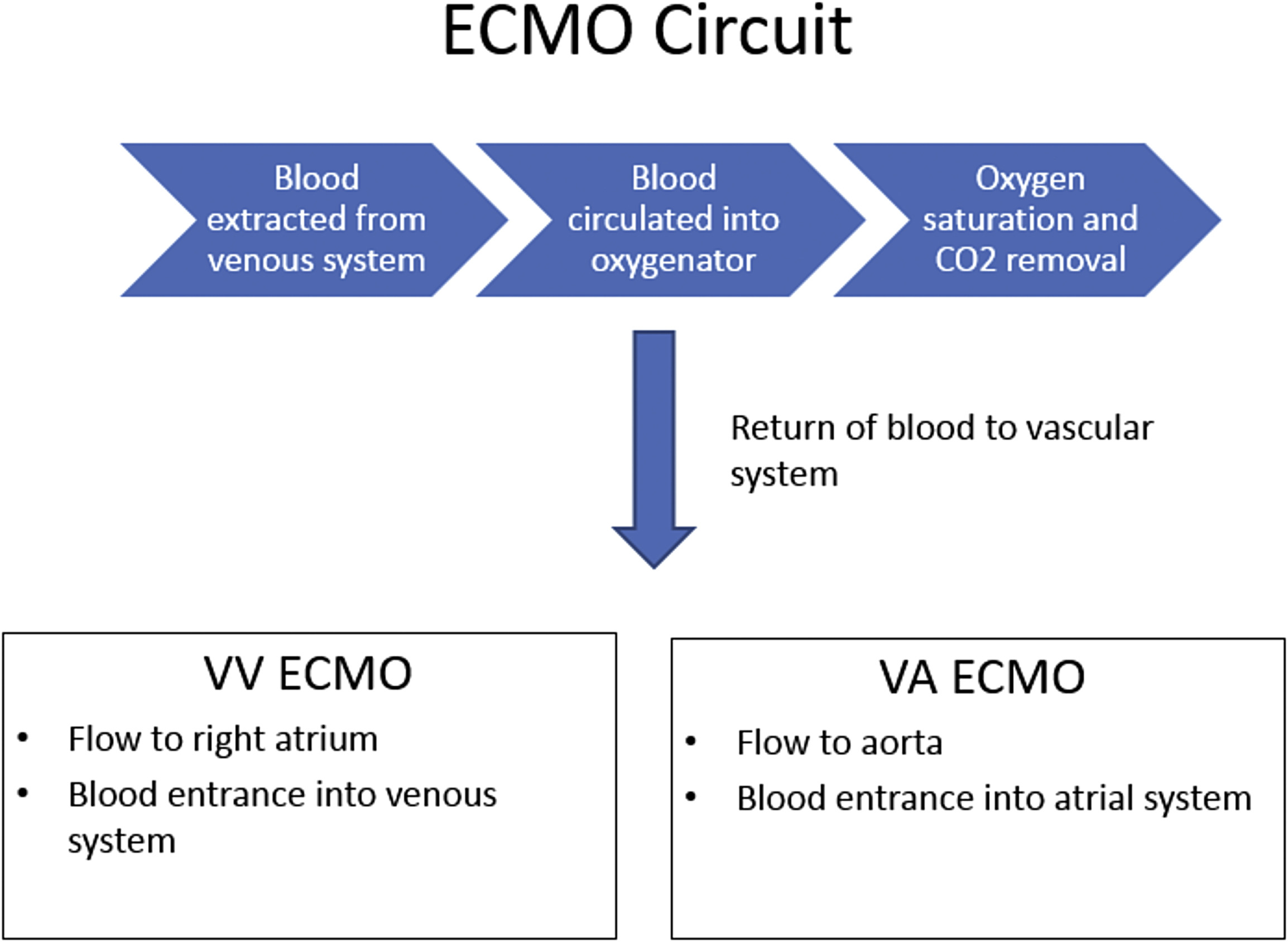
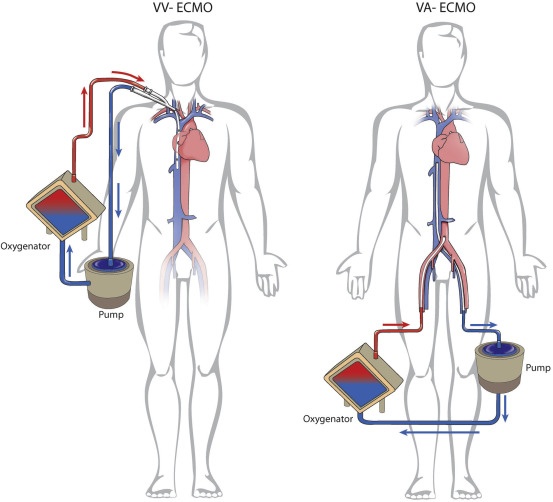
دو نوع اکمو شامل اکمو وریدی – وریدی (VV ECMO) و اکمو وریدی – شریانی (VA ECMO) وجود دارد ، هر دو مورد پشتیبانی تنفسی را فراهم میکنند ، در حالی که تنها اکمو وریدی – شریانی قادر به پشتیبانی همودینامیک می باشد .
- 1- وریدی – وریدی
- 2 – وریدی – شریانی
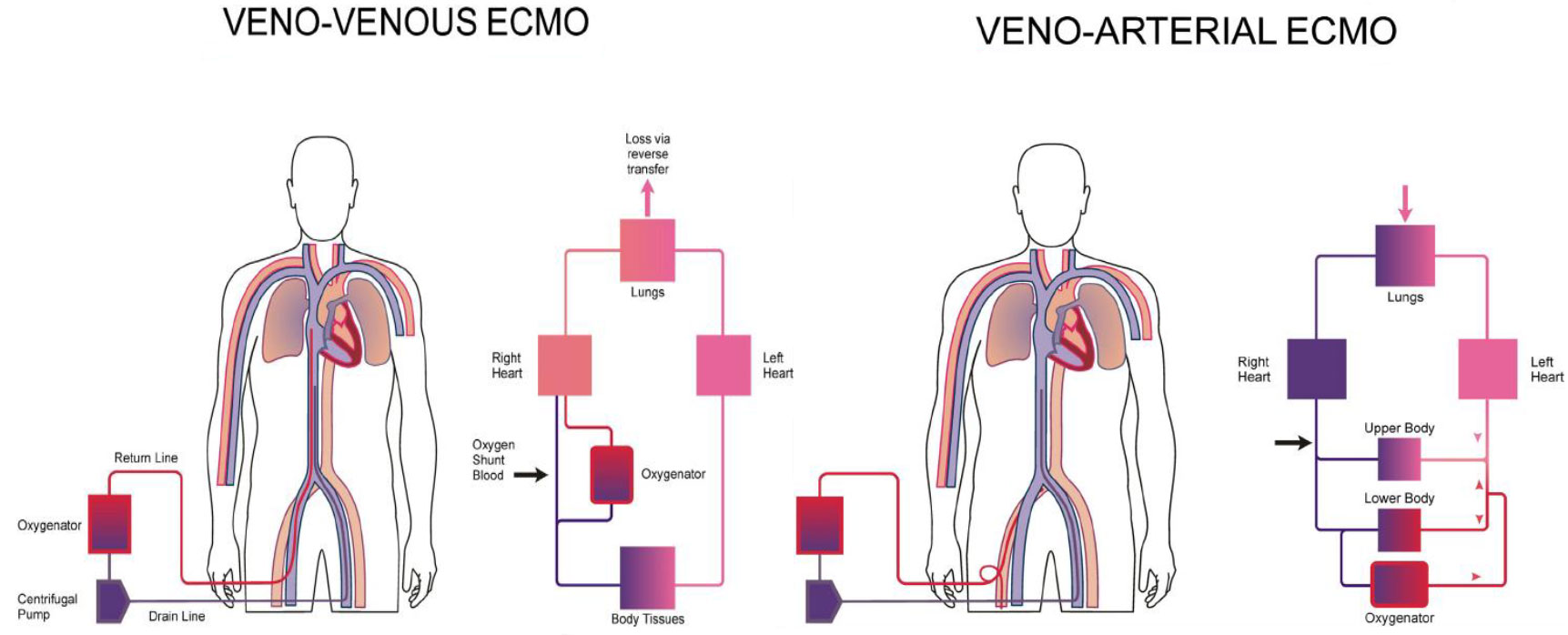
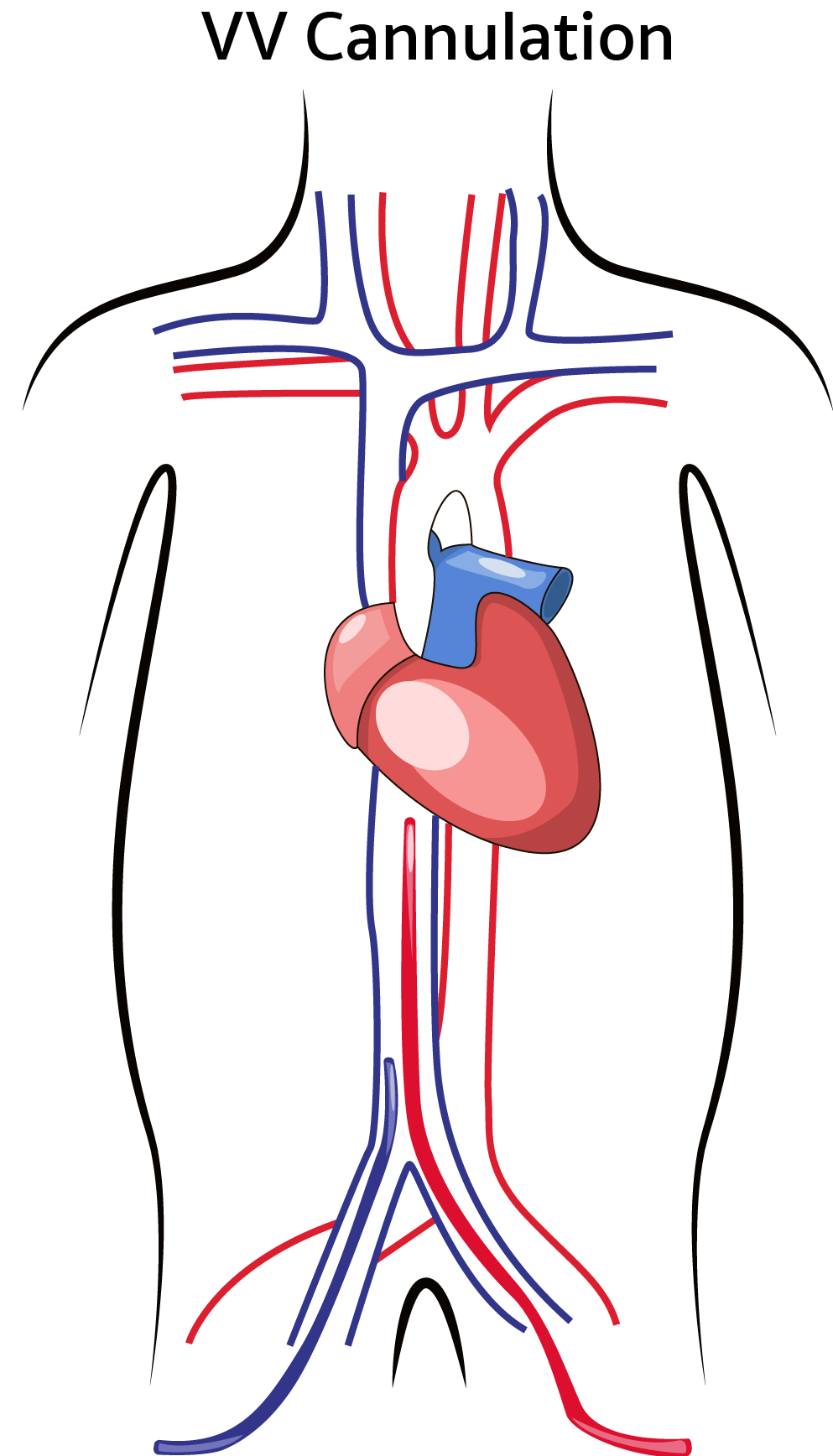 اکمو وریدی – وریدی ، خون وریدی را از وریدهای بزرگ مرکزی بیمار دریافت نموده و پس از عبور از یک اکسیژناتور به سیستم وریدی در نزدیکی دهلیز راست باز می گرداند. این دستگاه ، پشتیبانی حیات را در نارسایی های وخیم تنفسی وقتی بیمار نارسایی عمده قلبی نداشته باشد ، فراهم میکند . در برخی شرایط نظیر نارسایی وخیم تنفسی ، ممکن است به دلیل ناکافی بودن جریان و فلوی اکمو از یک کانول ، نیاز به کانول ثانویه نیز باشد .
اکمو وریدی – وریدی ، خون وریدی را از وریدهای بزرگ مرکزی بیمار دریافت نموده و پس از عبور از یک اکسیژناتور به سیستم وریدی در نزدیکی دهلیز راست باز می گرداند. این دستگاه ، پشتیبانی حیات را در نارسایی های وخیم تنفسی وقتی بیمار نارسایی عمده قلبی نداشته باشد ، فراهم میکند . در برخی شرایط نظیر نارسایی وخیم تنفسی ، ممکن است به دلیل ناکافی بودن جریان و فلوی اکمو از یک کانول ، نیاز به کانول ثانویه نیز باشد .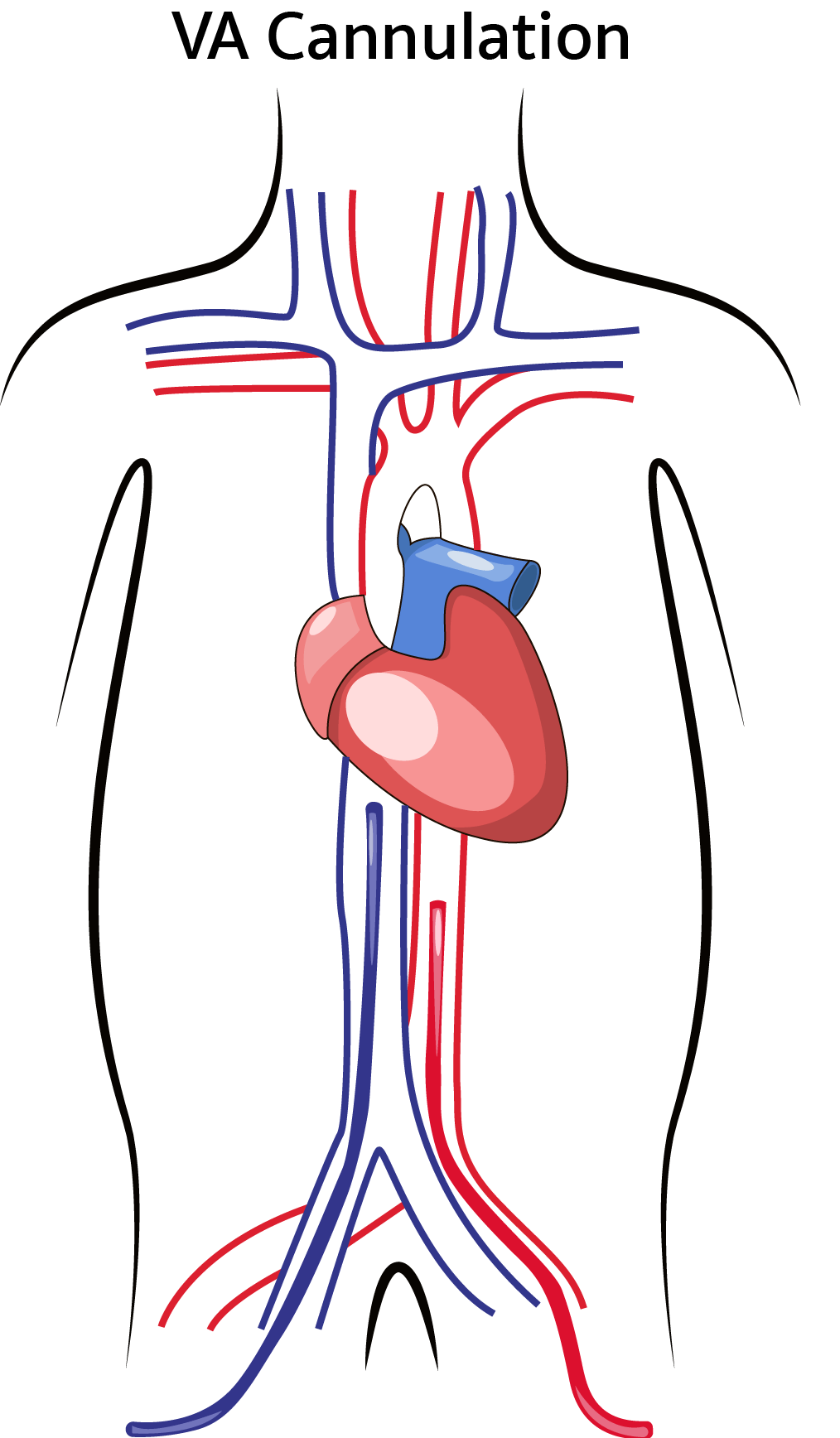 اکمو وریدی – شریانی خون وریدی را از وریدهای بزرگ مرکزی بیمار دریافت نموده و پس از عبور از یک اکسیژناتور به یک شریان اصلی باز میگرداند. این دستگاه پشتیبانی لازم را از نارسایی وخیم قلبی (که معمولاً همراه با نارسایی تنفسی است) عموماً پس از عمل جراحی قلب ، فراهم میکند.
اکمو وریدی – شریانی خون وریدی را از وریدهای بزرگ مرکزی بیمار دریافت نموده و پس از عبور از یک اکسیژناتور به یک شریان اصلی باز میگرداند. این دستگاه پشتیبانی لازم را از نارسایی وخیم قلبی (که معمولاً همراه با نارسایی تنفسی است) عموماً پس از عمل جراحی قلب ، فراهم میکند.
تعاریف کانول :
الف) کانول وریدی : خون را از سیستم وریدی به مسیر اکمو تخلیه می کند.
- کانول وریدی تک مرحله ای خون را از یک سوراخ کوچک در نزدیکی نوک تخلیه می کند.
- کانول دسترسی چند مرحلهای خون را از طریق حفرههای کناری در طول زیادی از کانول ، علاوه بر نوک آن تخلیه می کند
ب) کانول بازگشتی یا شریانی : خون را از مسیر اکمو و تنها از طریق نوک کانول (تک مرحلهای) به بیمار باز میگرداند.
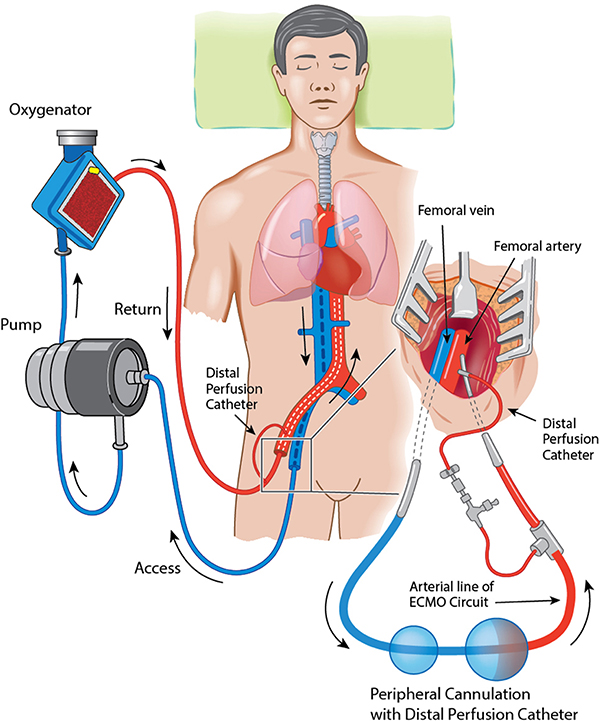
ج) کانول پرفیوژن دیستال : این کانول خون را به دیستال اندام و بعد از کانول شریانی اکمو بطور پیشرونده به شریان فمورال میرساند تا جریان خون را در پا تامین نماید . این کانول یک کانول صاف ۹F (یا مشابه آن) است .
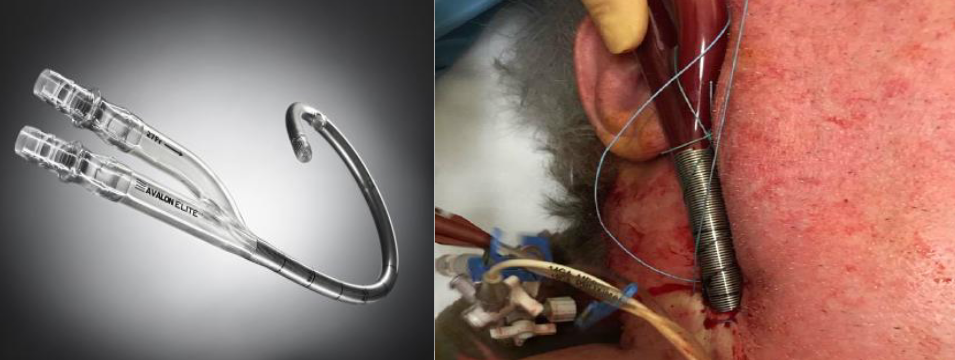
 د) کانول دو مجرایی : یک کانول تقسیم شده به دو مجرا با جریان خون وریدی و شریانی ، شبیه به کانول مورد استفاده در درمان های نارسایی کلیه (شالدون) می باشد.
د) کانول دو مجرایی : یک کانول تقسیم شده به دو مجرا با جریان خون وریدی و شریانی ، شبیه به کانول مورد استفاده در درمان های نارسایی کلیه (شالدون) می باشد.
- کانول بلند (۵۵ سانتیمتر) توسط تولیدکننده به صورت ” وریدی” نماد گذاری میشود و برای استفاده در سیستم وریدی طراحی شده اند.
- کانول کوتاه ( ۲۵ – ۱۵ سانتیمتر) توسط تولیدکننده به صورت “شریانی” نماد گذاری می شوند . اینها برای بازگشت خون در هر دو ترکیب وریدی – وریدی (فمورالی – گردنی) و وریدی – شریانی و برای خون وریدی که توسط ورید گردنی در ترکیب های با جریان بالای اکمو استفاده میشود ، کاربرد دارد. این کانول ها همچنین دارای دریچه های کناری اند که میتوانند به کانول تزریق وریدی دیستال ( در انواع محیطی وریدی – شریانی ) متصل گردند.
- اکمو وریدی – شریانی : همراه با پمپاژ خون از بخش وریدی به بخش شریانی ، به تبادل گاز و پشتیبانی خونرسانی کمک می کند
- اکمو وریدی – وریدی : تبادل گاز را تسهیل می نماید . خون از بخش وریدی دریافت میگردد و مجددا به خود بخش وریدی پمپاژ میگردد ، با این حال پشتیبانی خونرسانی را انجام نمی دهد .
- حرکت خون با کمک یک پمپ خارجی تسهیل می گردد ، این پمپ خون را به درون یک غشای تبادل گاز ( اکسیژناتور و از بین برنده دی اکسید کربن) و پیش از بازگشت به گردش خون بیمار به یک گرمکن هدایت میکند.
- ترکیب اکمو وریدی – شریانی به گونه ایست که قلب و ریه بیمار دور زده شده و تمام یا بخشی از جریان خون بیمار به مسیر اکمو منتقل میشود . در مقابل ، اکمو وریدی – وریدی خون را قبل از ورود به گردش ریوی ، باز می گرداند.
- وقتی که از مسیر بدون پمپ ( اکمو شریانی وریدی ) استفاده میگردد ، خون از شریان فمورال به سمت غشا جریان می یابد و بدون عامل خارجی به ورید فمورال باز میگردد، کل فرآیند وابسته به خروجی قلب بیمار است.
فیزیولوژی اکمو :
پاتوفیزیولوژی قلبی ریوی :
اکسیژن تحویلی یا (oxygen delivery یا DO2) مقدار کل اکسیژنی است که در دقیقه به بافت ها میرسد ، صرف نظر از توزیع جریان خون . اکسیژن مصرفی یا (oxygen consumption– VO2) مقدار کل اکسیژن خارج شده از خون به دلیل متابولیسم اکسیداتیو بافت در دقیقه است . رابطه DO2/VO2 میتواند از نوع بیماری ، در درجه اول از بیماری هایی که بر اکسیژندهی و خروجی قلب تأثیر میگذارند ، متأثر گردد . اگر DO2 در مقایسه با VO2 کاهش یابد (برای مثال در برونده پائین قلب ، کم خونی ، یا هیپوکسمی) ، VO2 با همان میزان ادامه یابد ، اکسیژن بیشتری به ازای دسی لیتر جریان خون استخراج شده ، و اکسیژن کمتری در خون وریدی وجود دارد (شبیه به فیزیولوژی عادی) در این حالت متابولیسم هوازی عادی ادامه مییابد .
وقتی DO2 کمتر از دو برابر VO2 باشد ، ذخیره اکسیژن به اندازه کافی نیست تا متابولیسم هوازی ادامه یابد در نتیجه و متابولیسم بی هوازی ایجاد می شود که به تولید اسید لاکتیک بجای CO2 می انجامد . یک نسبت DO2:VO2 کمتر از ۲:۱ منجر به اسیدوز سیستمی مبتنی بر ذخیره اکسیژن و نارسایی ارگان می شود . یک هدف مهم در مدیریت بحران در فرد بشدت بیمار ، ابقای نسبت DO2:VO2 در حد عادی ۵:۱ است ، یا حداقل بیشتر از مرز حیاتی ۲:۱ . لذا بسیار حائز اهمیت است که این نسبت را برای مدیریت بیمار به خوبی دانست .
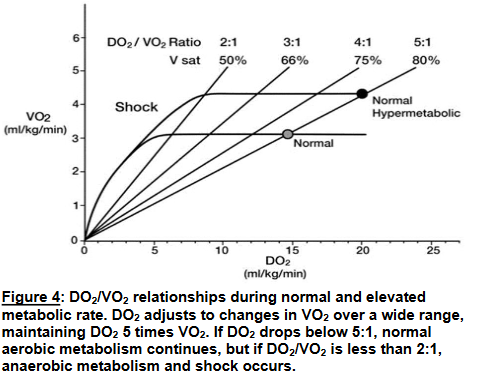
وقتی که اقدامات پزشکی لازم برای نگه داشتن DO2 در حد بیش از دو برابر VO2 (فشار بالا در مسیر هوایی ،FiO2 بالا ، و یا داروهای فعالساز عروق در دوزهای بالا) لازم شود . در ساده ترین شکل آن ، اکمو با تخلیه بخش اعظم خون وریدی ، پمپاژ آن به سمت غشای اکسیژناتور و بازگشت به گردش خون ، نسبت DO2:VO2 را در حد عادی نگه داری میکند . بخش اعظم خون ، ریه ها و قلب را دور زده و ارگان های مصنوعی فعالیت قلب و ریه های بیمار را جایگزین میکنند . در اکمو ، نسبت ایمنDO2:VO2 بازگردانده می شود و سیستم های آسیب رساننده ( تهویه مکانیکی و داروها ) متوقف میگردند . این امر زمانی را برای شناسایی عملکرد نامناسب ارگان و درمان آن فراهم میآورد که در اغلب موارد منجر به بازیابی فعالیت آن ها میشود.
وریدی – شریانی
الف : خونرسانی (همودینامیک)
وقتی خون وریدی از دهلیز راست تخلیه میگردد و به آئورت تزریق میشود ، جریان کلی ثابت باقی میماند اما الگوی پالسی کاهش می یابد زیرا خون کمتری از بطن چپ خارج میگردد . وقتی جریان خارجی ۱۰۰ درصد بازگشت وریدی است ، الگوی پالسی آن صاف است . این موقعیتی است که در روش وریدی – شریانی برای جراحی قلب (بای پس قلب و ریه CPB) پدید می آید . در CPB وناکاو فوقانی و تحتانی در نزدیکی کانول های تخلیه بسته میشوند تا تمامی بازگشت وریدی (بجز سینوس کرونری) به سمت مسیر میرود . در اکمو وریدی – شریانی ، جریان در حدود ۸۰ درصد بازگشت وریدی باقی می ماند ، بنابراین ۲۰ درصد جریان خون از درون قلب و ریه عبور میکند . دلیل آن اجتناب از جریان ایستا و لختگی در عروق ریوی و حفره های قلب ( که میتواند حتی در حضور تزریق سیستمی عامل ضد انعقاد رخ دهد) می باشد .
حتی در نارسایی شدید قلبی ، قلب میتواند مقدار اندکی خون پمپ کند وقتی که ۸۰ درصد گردش توسط مسیر اکمو تأمین میشود . در عمل ، این نسبت جریان خارجی به جریان قلب توسط الگوی پالسی در فشار حدود ۱۰ میلیمتر جیوه نشان داده می شود . بهترین راه ارزیابی عملکرد قلب در اکمو وریدی – شریانی استفاده از اکوکاردیوگرافی است . اگر قلب به کلی عمل نکند ، تمامی بازگشت وریدی به مسیر خارجی تخلیه میگردد و هیچ الگوی پالسی وجود ندارد .
ب : تبادل گاز
به هنگام اعمال اکمو وریدی – شریانی ، خون کاملا اشباع از اکسیژن به آئورت تزریق میگردد و با خون موجود در بطن چپ مخلوط می گردد . اگر ریه ها به درستی عمل کنند ، خون مخلوط شده به خوبی اکسیژن دار شده و PaCO2 عادی خواهد داشت . میتوان بیمار را از دستگاه تهویه مکتنیکی جدا نمود و او را به هوش آورد . اگر ریه ها ضعیف یا اصلا عمل نکنند ، گازهای خون سیستمی بر مخلوط جریانهای خارجی و قلبی اثر گذاشته و منجر به اکسیژندهی کمتر در پروگزیمال محل اختالط میشود . اگر اختالط در پروگزیمال آئورت باشد ، خون جاری به سمت مغز و گردش کرونری به خوبی اکسیژن دار خواهد بود .
وریدی – وریدی
الف : خونرسانی
خونرسانی به هنگام دسترسی وریدی – وریدی عادی است . از آنجا که حجم خون جدا شده دقیقاً برابر با خون باز تزریقی است ، اثری بر فشار وریدی مرکزی ، پر شدن بطنهای راست یا چپ ، یا خونرسانی نمیگذارد . محتوای اکسیژن و CO2 در خون شریانی بیمار نمایانگر همین محتوا در خون بطن راست است البته اصلاح توسط ریه که ممکن است وجود داشته باشد . جریان خون سیستمی ، خروجی بومی قلب است و ارتباطی به جریان خارجی ندارد .
ب : تبادل گاز
در اکمو وریدی – وریدی ، مقداری از بازگشتی وریدی سیستمی به سیستم اکمو تخلیه شده ، اکسیژنه شده و به دهلیز راست بازگردانده میشود . مقداری از بازگشت وریدی سیستمی مستقیماً به دهلیز راست می رود جایی که در آن جا با خون تزریقی اکمو مخلوط میگردد . خون مخلوط شده ، از بطن راست ، ریه های فرد و قلب چپ عبور میکند و به گردش سیستمی وارد میشود. در نارسایی شدید تنفسی ، ریه های فرد کمک اندک یا هیچ کمکی به تبادل گاز نمیکنند ، لذا اکسیژندهی و CO2 شریانی نتیجه اختالط خون اکمو با خون وریدی بومی فاقد اکسیژن است . در نتیجه ، اشباع شریانی در محدوده ۶۰ درصد تا ۹۰ درصد متغیر است ، و بسته به مقدار نسبی جریان اکمو ، جریان وریدی بومی ، عملکرد ریه و خروجی قلب تغییر میکند.
مادامی که خروجی قلب و غلظت هموگلوبین به حد کافی باشد خون شریانی فاقد اکسیژن منجر به اکسیژن رسانی سیستمی عادی میشود . این روابط اغلب برای کارکنان بخش مراقبت های ویژه گیج کننده است ، زیرا هدف مشترک کنترل بیمار ، نگه داری حد اشباع شریانی در میزان بالای ۹۰ درصد است .
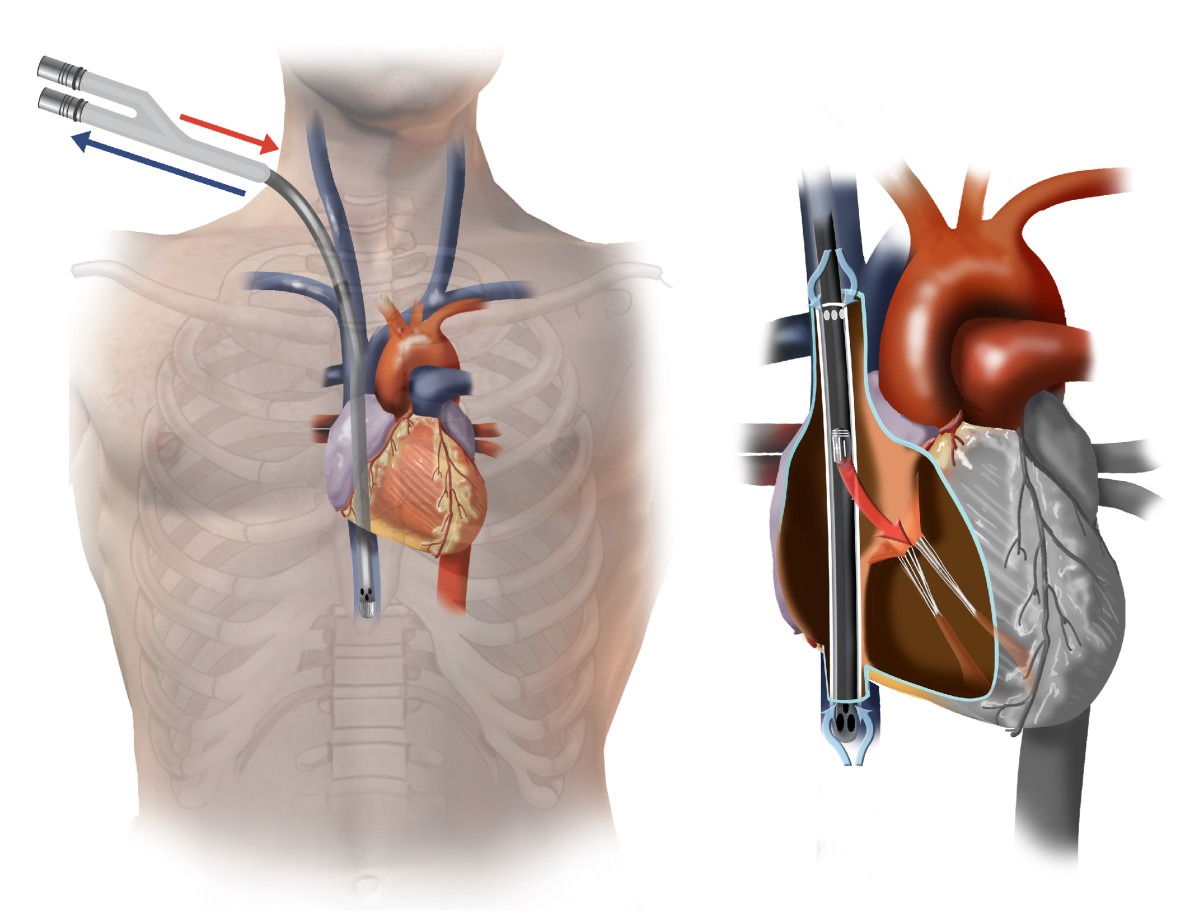
روش کانولاسیون :
اکمو وریدی شریانی (VA ECMO)
- کانول وریدی از طریق ورید فمورال بگونه ای که نوک آن در دهلیز راست بدون تماس به سپتوم بین دهلیزی قرار گیرد ، داخل میشود. اندازه کانول معمول ۲۱-۲۵ F است.
- کانول بازگشتی یک کانول شریانی کوتاه است که از طریق شریان فمورال مشترک وارد میشود . نوک این کانول در درون شریان ایلیاک مشترک یا آتورت تحتانی قرار میگیرد. سایز معمول آن ۱۷-۲۱ F است.
- یک کانول شریانی اضافی ۹F برای خونرسانی به دیستال اندام (کانول پشتیبان – backflow cannula) به طور پیشرونده درون شریان فمورال مشترک وارد میگردد و به سمت شریان فمورال سطحی هدایت میشود. در آنجا به دریچه کناری کانول شریانی بازگشتی متصل شده و به خوبی محکم میشود.
مزایا : پشتیبانی جزئی یا کامل قلب را فراهم میکند . همچنین قابلیت پشتیبانی مسیر اتصال CRRT (Continuous renal replacement therapy) را داراست .
معایب : خطر هیپوکسی ناهمسان ، که اگر در شرایط نارسایی وخیم تنفسی عملکرد طبیعی قلب بهبود یابد ممکن است نیاز به تغییر به ترکیب جریان بالا داشته باشد .
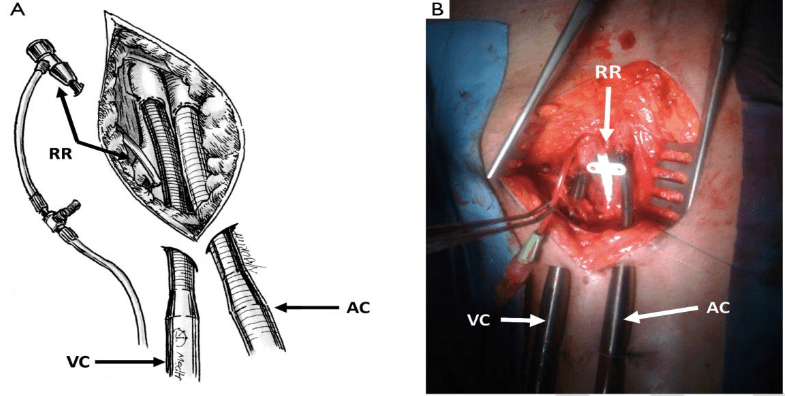
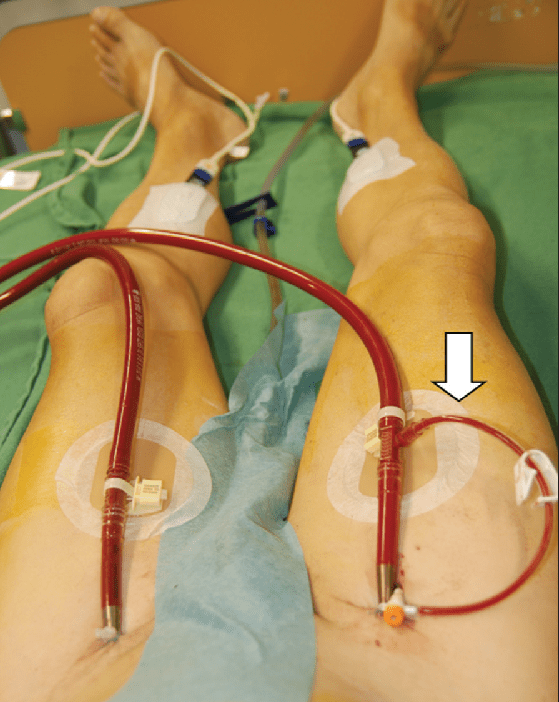
ب : کانول زدن اورژانسی فمورال – فمورال
- شبیه به کانول زدن استاندارد فمورال – فمورال است اما از کانول های کوچکتری که سرعت بالاتری در داخل کردن دارند ، استفاده میکنند .
- اندازه معمول ۱۹-۲۱ F چندمرحله ای برای ورید و ۱۵F بازگشتی برای شریان .
- کانولهای پشتیبان نیز فقط پس از آغاز اکمو داخل میشوند .
مزایا : سرعت بالاتر تعبیه کردن . قابلیت استفاده در بیماران تحت CPR و یا بیماران پیش یا پس از ایست قلبی
معایب : فشارهای بالای مسیر ( در اثر استفاده از کانول بازگشتی کوچکتر ) ممکن است CRRT را پشتیبانی نکند. خظر هیپوکسی ناهمسان ، که اگر در شرایط نارسایی وخیم تنفسی عملکرد طبیعی قلب بهبود یابد ممکن است نیاز به تغییر به ترکیب جریان بالا داشته باشد.
- از کانولهای جراحی استفاده میکند . کانول وریدی با سیم مقاومسازی شده که درون دهلیز راست از طریق گوشک دهلیز قرار میگیرد . در ادامه کانول از سینه خارج شده و استرنوم مسدود میگردد. اندازه معمول بزرگتر از ۳۰ F است.
- نوک کانولهای بازگشتی از جنس داکرون است و بطور مستقیم به آئورت مجاور بخیه میشود. در ادامه کانول از سینه خارج شده و استرنوم مسدود میگردد. اندازه معمول بزرگتر از ۳۰F است .
مزایا : قابلیت این را دارد که سیستم قلب و ریه را پشتیبانی کند و نیز هیپوکسی ناهمسان را به موقع نارسایی تؤامان قلبی و تنفسی به همراه ندارد. قابلیت پشتیبانی بهینه برای نارسایی وخیم قلبی و ریوی پس از کاردیوتومی . اجازه میدهد تا استرنوم بسته شود و مراقبت استاندارد از منطقه های تحت فشار بیمار را تسهیل میکند. فشار پائین مسیر به آسانی اتصال CRRT را پشتیبانی میکند. میتواند پشتیبانی را تا دو هفته فراهم کند.
معایب : برش استرنوم برای جایگذاری و باز کردن دوباره برای جداسازی کانول الزامی است. خونریزی نسبت به نوع فمورال – فمورال شایع تر است.
از کانول وریدی یا آتورتی استفاده میکند که از طریق استرنوم باز بیرون می آید.
معایب : خونریزی بیشتر . بیش از ۵ روز قادربه پشتیبانی از بیمار به طور ایمن نیست . استرنوم باز مانع از مراقبت استاندارد از منطقه فشار بیمار می شود
روش کانولاسیون :
اکمو وریدی – وریدی (VV ECMO)
- دو کانول بلند وریدی به کار میرود.
- جهت جریان از وناکاو به دهلیز است تا بازگردش را حداقل سازد.
- کانول دسترسی (تک مرحله ای یا چندمرحلهای) از طریق ورید فمورال داخل میرود و نوک آن درون وناکاوا تحتانی کبدی قرار میگیرد. اندازه معمولی آن F21-25 است.
- کانول بازگشتی (تک- مرحله ای) از طریق ورید فمورال سمت مقابل داخل میرود به نحوی که نوک آن درون دهلیز راست قرار گیرد. اگر نوک آن بیش از حد پیش رود با سپتوم بین دهلیزی برخورد خواهد نمود . اندازه معمول آن F 21-25 است.
- نوک کانول دسترسی ، ۱۵ – ۱۰ سانتیمتر پائینتر از نوک کانول بازگشتی قرار میگیرد تا بازگردش را حداقل نماید.
مزایا : داخل نمودن سریع و ایمن ، محکم نمودن اتصال کانول آسانتر است ، فشارهای مسیر امکان اتصال به CRRT را میدهد.
معایب : محدودیت در شدت جریان حداکثر ، به نحوی که اغلب نیاز به تغییر به یک ترکیب جریان بالا وجود دارد ، بیمار ناچار به باقیماندن در تخت است.
ب : فمورال – گردنی
- جهت جریان از وناکاوا به دهلیز است تا بازگردش را حداقل نماید.
- کانول دسترسی (چندمرحلهای) از طریق ورید فمورال داخل میرود به نحوی که نوک آن درست در زیر اتصال وناکاوا به دهلیز قرار گیرد. اندازه معمول آن F 21-25 است.
- کانول بازگشتی کوتاه (شریانی) از طریق ورید ژوگولار داخلی راست گردن وارد شده و نوک آن در وناکاوا تحتانی قرار میگیرد. خون بازگشتی در این جهت ترجیحاً به سمت دریچه تریکوسپید و بطن راست جریان می یابد، که این امر بازگردش را حداقل میسازد. اندازه معمول آن ۱۹-۲۳ F است.
مزایا : قابلیت این را دارد تا همواره پشتیبانی کافی ( ۷ – ۵ لیتر بر دقیقه) را بدون بازگردش عمده فراهم آورد به نحوی که تنها دو ورید اشغال میشوند. فشارهای مسیر امکان اتصال به CRRT را فراهم میکند.
معایب : نسبتاً مشکل است که بتوان کانول بازگشتی را در ورید گردنی به خوبی و در امنیت کامل پوشاند و پانسمان کرد. این روش نیازمند دو ناحیه استریل در دسترس به هنگام کانول زنی اکمو است. شناسایی عدم کافی بودن دسترسی برای کانولها در مراحل اولیه بدون استفاده از کنترل فشارهای منفی مشکل خواهد بود. بیمار ناچار به ماندن در تخت است.
- جهت جریان در هر دو از وناکاوا به دهلیز است تا بازگردش به حداقل برسد
- از یک کانول با دو مجرا برای دسترسی و بازگشت خون از طریق ورید ژوگولار داخلی راست گردن استفاده میشود. دو مرحله دسترسی ( SVC و IVC )
- ورودی بازگشتی از بین دو ورودی قسمت وریدی بیرون آمده و در سطح دریچه تریکوسپید قرار میگیرد.
مزایا : استفاده از یک کانول با تنها یک ورید . امکان حرکت بیمار از تخت را فراهم میکند.
معایب : دقت در هنگام کانولاسیون ضروری است تا از جاگذاری در بطن راست ، پارگی و کانولاسیون در ورید کبدی اجتناب گردد . نیاز به کانول بزرگی برای داخل نمودن است ( ۲۷F یا ۳۱F برای بزرگسالان). دشواری در قرار دادن ورودی برگشتی به سمت دریچه تریکوسپید. دشواری در انجام CRRT از طریق این مسیر به علت فشارهای مسیر. مسیر را بایستی با دقت ایمن ساخت تا پاسخگوی وزن مهارنشده مسیر اکمو ، باشد تا از جابجایی سوزن ( یا جدا شدن تصادفی کانول) و جراحت حاصل از فشار جلوگیری نمود.
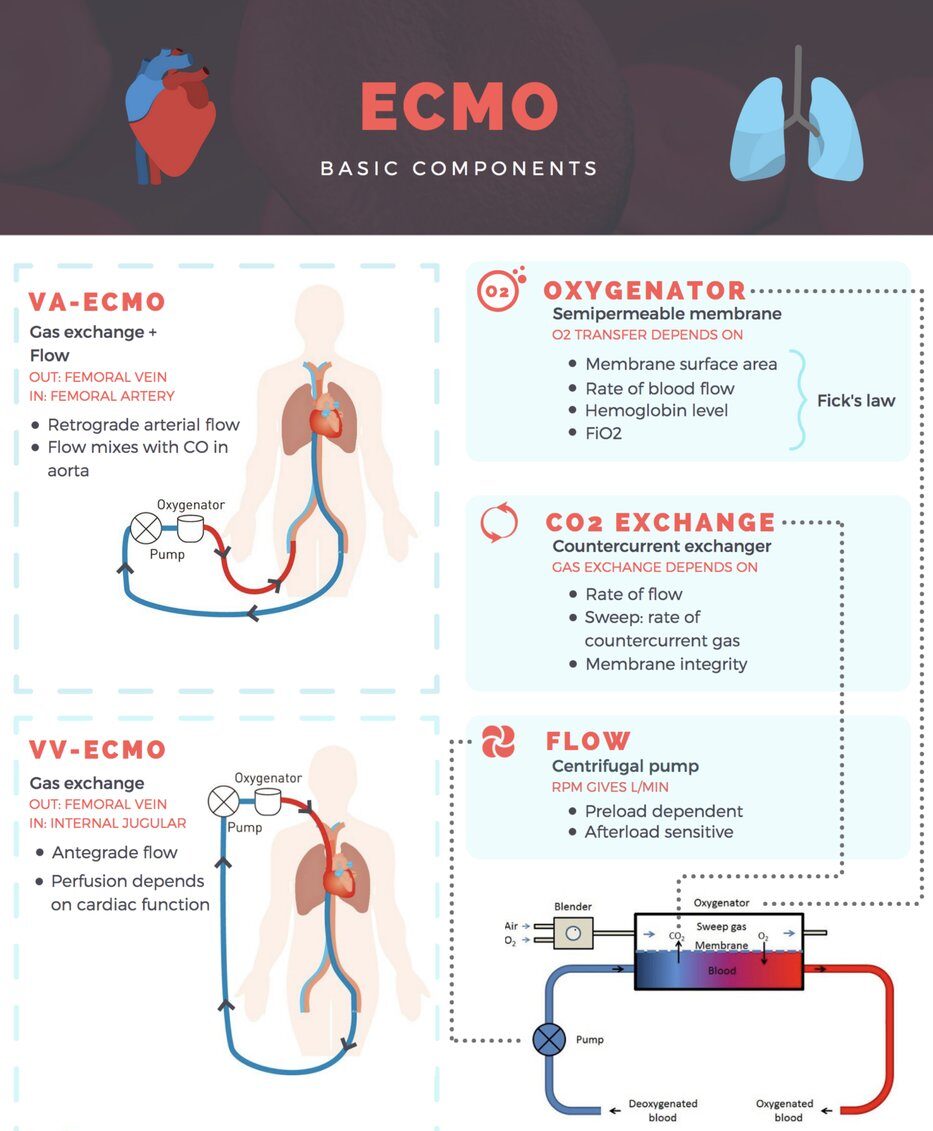
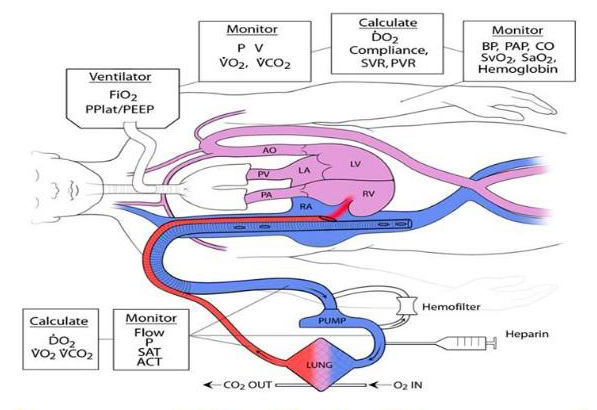
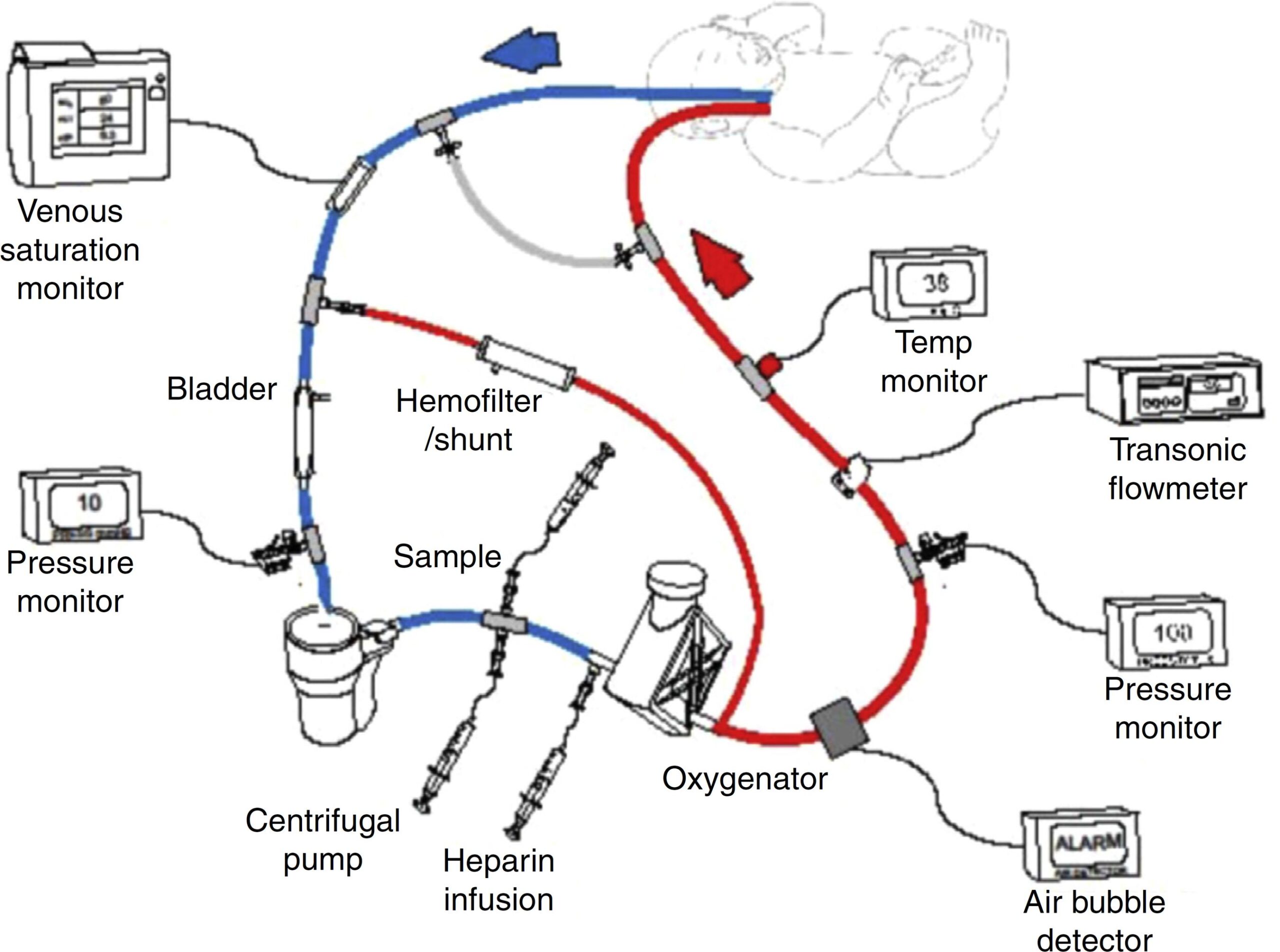
مدار اکمو :
یک مسیر استاندارد اکمو متشکل است از یک پمپ مکانیکی ، ابزار تبادل گاز (غشای اکسیژناتور) و یک مبدل گرمایی که همگی به یکدیگر در طول یک مسیر لوله ای بین کانول دسترسی و کانول بازگشت شریانی یا وریدی قرار دارند . لوله کشی مسیر از جنس ترکیبات پلاستیکی بتنی بر PVC ساخته شده اند. مسیرهای اکمو از ساده به پیچیده متغیرند و هر کدام ممکن است شامل طیفی از ترنسدیوسر ها جهت مانیتورینگ جریان ها خون و کنترل فشار خون ، کنترل مداوم مقدار اشباع اکسی هموگلوبین ، محل های دسترسی مسیر و یک پل متصل به دسترسی وریدی و تزریق شریانی به اندام باشد . در حین حرکت در مسیر اکمو خون در معرض سطح زیادی قرار میگیرد که منجر به هدر رفت چشمگیر دما می گردد و کودکان نیازمند گرمایش مستقیم خون برای ابقای دمای بدن هستند .
پمپ ها
Pumps یک پمپ جزء ضروری مسیر اکمو است . پمپ های غلتکی نیمه انسدادی ، برای دهه ها استاندارد بوده اند ، اما عمدتا با پمپ های گریز از مرکز(centrifugal) جدید جایگزین شده اند. پمپ اکمو می بایست جریان را متناسب با بیمار (معمولا بین۱۵۰ – ۷۵ میلی لیتر بر کیلوگرم بر دقیقه برای نوزادان و کودکان) در یک محدوده ایمن فشاری برای اجتناب از همولیز فراهم کند. فشار خروجی تابعی از سرعت پمپ و مقاومت موجود در لوله کشی ، کانول ، و فشار شریانی بیمار است . خطر فشار خروجی بالا پارگی مسیر است . مسیر بایستی فشار ۶۰۰ میلی متر جیوه را تحمل کند اما فشار ۳۰۰ میلی متر جیوه برای حد ایمن بالایی برای اغلب کاربردها در نظر گرفته می شود . خطر فشار پائین ورودی همولیز است ، زمانی که حباب های گازی در خون شکل میگیرد (فشار مکش بیش از۶۰۰ میلی متر جیوه) .
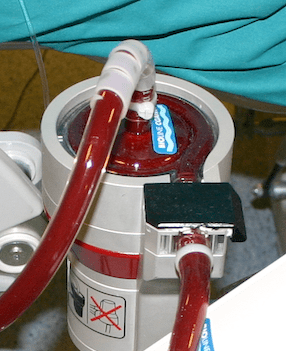 وقتی پمپ های گریز از مرکز برای جراحی قلب مورد استفاده قرار می گیرند ، پمپ مستقیما به مخزن وریدی متصل شده و تنظیم با حسگر سطح یا اپراتور پمپ فراهم می شود. در یک روز دفعات زیادی ممکن است که تخلیه وریدی مسدود شود (برای مثال ؛ هنگام سرفه ، کاهش حجم خون یا پیچ خوردگی که بصورت قروچه کردن خط وریدی بروز می کند). وقتی خط وریدی مسدود می گردد ، موتور به حرکت ادامه می دهد ، خون را از سر پمپ تخلیه می کند و یک خلایی در سر پمپ ایجاد می کند که منجر به حباب سازی و همولیز می شود . این اتفاق در یک ثانیه رخ می دهد (یا یک هزارم ثانیه در دورهای بالا )، لذا هیچ سیستم تنظیم به اندازه کافی سریع نیست که از حباب سازی جلوگیری کند. این مشکل را می توان با استفاده از یک کیسه باقابلیت جمع شدن به حداقل رساند
وقتی پمپ های گریز از مرکز برای جراحی قلب مورد استفاده قرار می گیرند ، پمپ مستقیما به مخزن وریدی متصل شده و تنظیم با حسگر سطح یا اپراتور پمپ فراهم می شود. در یک روز دفعات زیادی ممکن است که تخلیه وریدی مسدود شود (برای مثال ؛ هنگام سرفه ، کاهش حجم خون یا پیچ خوردگی که بصورت قروچه کردن خط وریدی بروز می کند). وقتی خط وریدی مسدود می گردد ، موتور به حرکت ادامه می دهد ، خون را از سر پمپ تخلیه می کند و یک خلایی در سر پمپ ایجاد می کند که منجر به حباب سازی و همولیز می شود . این اتفاق در یک ثانیه رخ می دهد (یا یک هزارم ثانیه در دورهای بالا )، لذا هیچ سیستم تنظیم به اندازه کافی سریع نیست که از حباب سازی جلوگیری کند. این مشکل را می توان با استفاده از یک کیسه باقابلیت جمع شدن به حداقل رساند
می توان از Better Bladder در خط وریدی استفاده نمود که می تواند شبیه به یک مخزن کوچک همراه با تنظیم مبتنی بر دور پمپ بر روی حسگر فشار ورودی ، حباب سازی را به حداقل رساند. در واقع این ساز و کار از تداوم مکش وقتی که خط برای بیشتر از چند ثانیه مسدود شده است ، جلوگیری می کند.
اکسیژناتور :
Oxygenators  مسیرهای اکمو دارای یک ابزار تبادل گاز هستند که اکسیژنده یا اکسیژنراتور نام دارد ، که اکسیژن را به خون افزوده و دی اکسید کربن را از آن می زداید . این ابزار ممکن است چندین زیست ماده متفاوت شامل لاستیک سیلیکونی مانند آنچه در غشاهای ریههای مصنوعی برای سال ها استفاده میشود است ، فیبرهای توخالی از جنس پلی پروپیلن برای استفاده کوتاه مدت ، سطوح فشرده از جنس پلی متیل پنتن ، و نیز پلی وینیل کلراید ، پلی یورتان و استیل زنگ نزن را در برگیرد . سطح در دسترس و مسیر اختلاط خون ، حداکثر ظرفیت اکسیژندهی هر ابزار تبادل گاز را تعیین می کند . میزان جریان یک دستگاه اکسیژناتور با مقدار خون غیر اشباعی (۷۵ درصد) که در هر دقیقه می تواند به حالت کاملا اشباع (۹۵ درصد) رساند ، تعریف میشود .
مسیرهای اکمو دارای یک ابزار تبادل گاز هستند که اکسیژنده یا اکسیژنراتور نام دارد ، که اکسیژن را به خون افزوده و دی اکسید کربن را از آن می زداید . این ابزار ممکن است چندین زیست ماده متفاوت شامل لاستیک سیلیکونی مانند آنچه در غشاهای ریههای مصنوعی برای سال ها استفاده میشود است ، فیبرهای توخالی از جنس پلی پروپیلن برای استفاده کوتاه مدت ، سطوح فشرده از جنس پلی متیل پنتن ، و نیز پلی وینیل کلراید ، پلی یورتان و استیل زنگ نزن را در برگیرد . سطح در دسترس و مسیر اختلاط خون ، حداکثر ظرفیت اکسیژندهی هر ابزار تبادل گاز را تعیین می کند . میزان جریان یک دستگاه اکسیژناتور با مقدار خون غیر اشباعی (۷۵ درصد) که در هر دقیقه می تواند به حالت کاملا اشباع (۹۵ درصد) رساند ، تعریف میشود .
به مدت ۵۰ سال غشای ریه مصنوعی از لاستیک سیلیکونی بنام کولوبوو ، استاندارد برای کاربردهای اکمو بوده است . این غشا از یک ورقه مقاوم شده مسطح ساخته شده است که بطور پوشا به دور یک شبکه توری به حالت مارپیچ پیچیده شده است . خون و جریان هوا بطور متقابل در درون ریه سیلیکونی جریان می یابند و تبادل گاز از طریق نفوذ از میان غشا اتفاق می افتد . این غشای اکسیژناتور در تبادل اکسیژن و کربن دی اکسید بسیار مؤثر است اما ضروریست که طیفی از اندازه های مختلف برای پشتیبانی از بیماران با اندازه متفاوت در دسترس باشد .
با نوجه به ماهیت طراحی آن و مقاومت بالایش ، اکسیژناتور سیلیکونی در برابر هواگیری مقاومت می کند ، که این مسئله زمان بیشتری را برای آماده سازی می طلبد و دیگر آن که حمل و نقل آن مشکل تر است . تعداد زیادی غشای اکسیژناتور از جنسPMP در کاربرد تجاری وجود دارد از این جمله می توان به موارد زیر اشاره نمود :
- (Maquet, Hirrlingen, Germany) , Hilite LT
- (Sorin, Mirandola Modena, Italy) , Quadrox–iD
- (Sorin, Mirandola Modena, Italy) , Lilliput 2
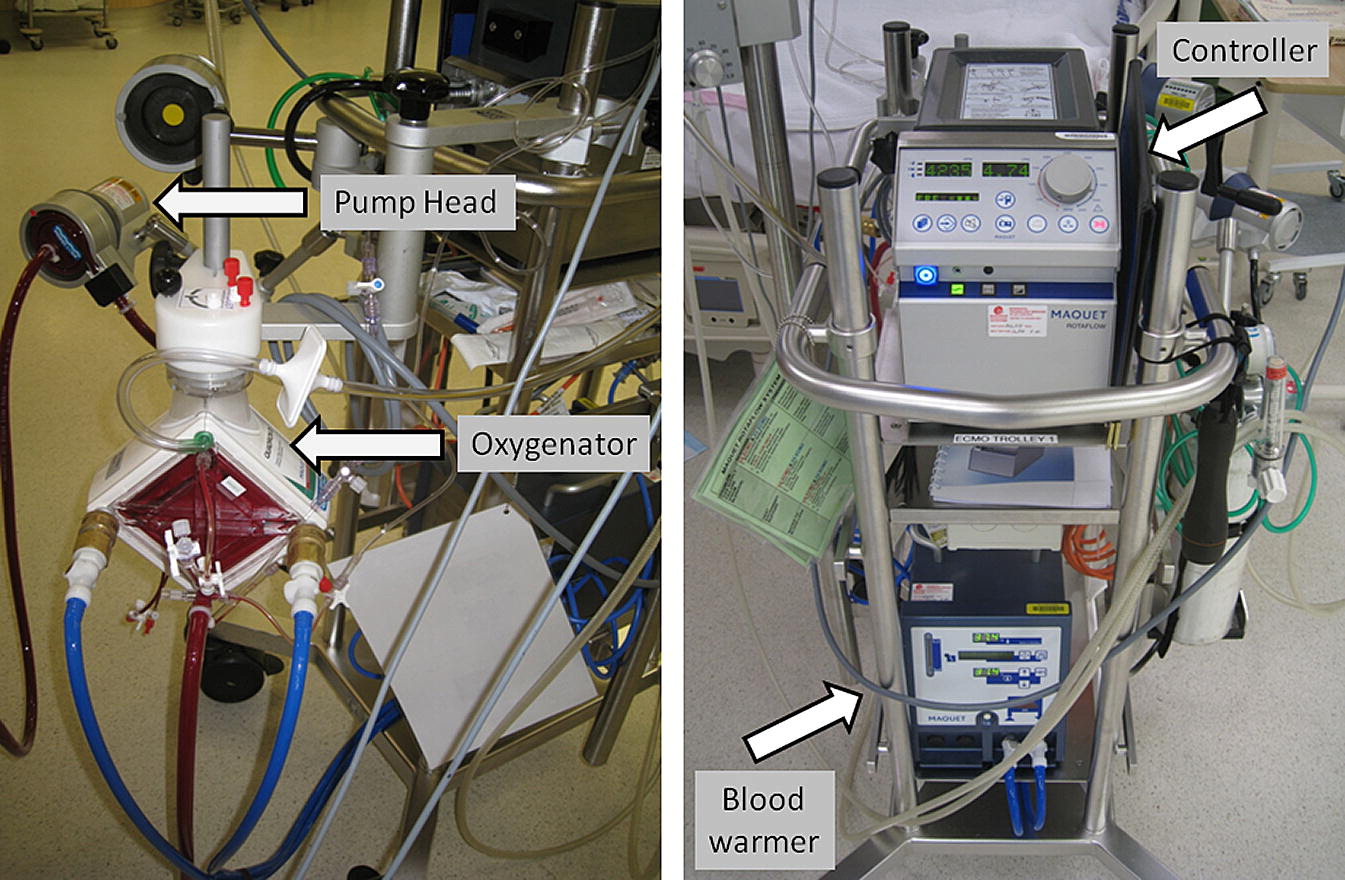
کنسول کنترل
Control Console پمپاژ توسط یک کنسول کنترلی مرکزی (واحد درایو) کنترل می شود ، که در آن تنظیمات ، هشدارها و پارامترهای کنترلی عملیاتی قابل تنظیم است . معمولا پارامتر مورد استفاده در ICU ، سرعت پمپ (RPM) همراه با جریان خون تخلیه شده در ارتباط با پره لود و افترلود است. سرعت برای دستیابی به جریانی که انتقال کافی اکسیژن را تضمین نماید ، انتخاب می گردد. به هنگام پشتیبانی خارجی ، همواره باید یک موتور دستی وجود داشته باشد تا در موارد فوریتی مانند خرابی موتور اصلی و یا خلل در ورود جریان ، مورد استفاده قرار گیرد .

توصیه ها و ممنوعیت استفاده :
- Indication
اکمو وریدی – شریانی : این مورد برای مدیریت نارسایی قلبی – ریوی یا جایی که استفاده از یک دستگاه کمک بطنی (VAD , device assist Ventricular ) نامناسب پنداشته شود
اکمو وریدی – شریانی مرکزی : در مواردی که اکمو وریدی – شریانی برای پشتیبانی قلبی لازم است و جایی که عملکرد ریه ضعیف است ، استفاده از اکمو وریدی – شریانی محیطی بایستی اجتناب شود . دلیل آن اینست که هر خروجی بومی قلب خون فاقد اکسیژن را از وریدهای ریوی به گردش مغزی میرساند . اکمو وریدی – شریانی مرکزی اغلب در بیماران تحت جراحی قلب مورد استفاده قرار میگیرد.
اکمو وریدی – شریانی محیطی : زمانی مناسب است که عملکرد منطقی ریه وجود داشته باشد و جراحی قلب لازم نباشد.
اکمو وریدی – شریانی با جریان پائین : تنها برای پشتیبانی و تثبیت اولیه در شرایط فوریتی مستلزم پشتیبانی وریدی – شریانی استفاده می گردد.
اکمو وریدی – وریدی : این مورد منحصراً برای نارسایی تنفسی است وقتی که عملکرد کافی قلب برای ادامه کار اکمو مهیا باشد.
اکمو وریدی – وریدی با جریان بالا : این مورد وقتی استفاده می شود که جریان مسیر از طریق یک کانول دسترسی منفرد برای اکسیژنزنی ایمن ناکافی باشد . این رخداد ممکن است زمانی رخ دهد که کانول دسترسی کوچکتری به طور زیر پوستی قرار گرفته باشد ، که در آن نیاز به کانول دسترسی ثانویه مبرم باشد (برای مثال از یک ورید داخلی گردنی)
کافی نبودن خونرسانی به بافت ها که با فشار پایین و خروجی کم قلب علیرغم حجم کافی درون عروق بروز مییابد . علیرغم انفوزیون حجم ، اینوتروپ ها یا تنگ کننده های عروق و بالون پمپ درون آئورتی شوک ادامه یابد
هیپوکسمی شدید در شرایط ARDS ، برای مثال یک نسبت paO2 به FiO2 کمتر از ۸۰ ، علیرغم بکار بردن سطح بالای PEEP (معمولا بین ۲۰-۱۵ سانتیمتر جیوه) برای حداقل مدت ۶ ساعت در بیماران دارای پتانسیل نارسایی تنفسی برگشت پذیر


- Contraindication
کنترا اندیکاسیون برای تمامی حالات اکمو
- سنین بالای ۷۵سال
- بیماری قلبی غیر قابل برگشت
- بیماری ریوی غیر قابل برگشت
- بیماری اعصاب غیر قابل برگشت
- سرطان فعال ، پیوند در برابر بیماری میزبان ، سرکوب ایمنی
- عدم فعالیت مزمن ارگان (کبد ، کلیه)
- وزن بیش از۱۴۰
- ایست قلبی و یا CPR بیش از ۶۰ دقیقه پیش از آغاز اکمو
- محدودیت کمپلیانس ( شناختی ، روانی و اجتماعی)
- نارسایی چند ارگان
- نارسایی شدید دریچه میترال یا آئورت
- هایپرتنشن شدید ریوی (mPAP > 50 mmHg)
- منع استفاده از ضد انعقاد ، تروما همراه با نواحی خونریزی متعدد
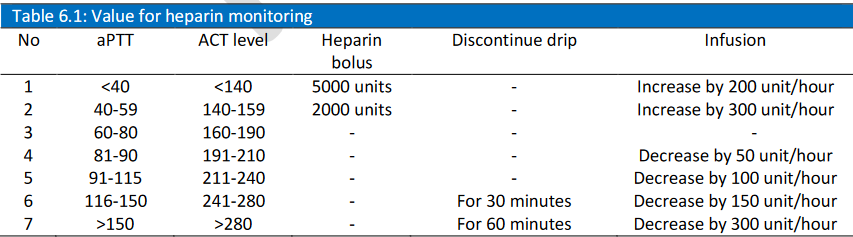
پروتکل هپارین :
 گام نخست : هپارین بایستی به محض ایجاد سوراخ در رگ و هدایت سیم در آن به بیمار داده شود .
گام نخست : هپارین بایستی به محض ایجاد سوراخ در رگ و هدایت سیم در آن به بیمار داده شود .
دوز اول بایستی ۱۰۰ واحد به ازای کیلوگرم باشد . اگر بیمار ظرف زمان ۱۵ دقیقه پس از دوز اولیه تحت اکمو نبود ، یک تست زمان لختگی )Activated clotting time – ACT( نیز می بایست برای کنترل از بیمار گرفته شود . اگر تست زمانACT کمتر از ۲۰۰ ثانیه باشد ، یک دوز اضافی ۱۰ تا ۲۰ واحد بر کیلوگرم از هپارین بایستی تجویز شود.
گام دوم : تست ACT را پس از ۱ ساعت از تجویز هپارین و بسته به آغاز زمان لختگی با ابقای دوز هپارین تکرار کنید.
دوز ابقاء بایستی با ۲۰ واحد به ازای کیلوگرم در ساعت آغاز شود.
گام سوم : سطح زمان لختگی (ACT) بایستی در ۱۸۰ تا ۲۰۰ ثانیه باقی بماند ، و در موارد خونریزی ، زمان لختگی را می توان در حد ۱۴۰ تا ۱۶۰ حفظ نمود . تست زمان لختگی را هر ۴ ساعت تکرار کنید و در صورت عدم ثبات این تست را هر ساعت برای بزرگسالان تکرار نمائید . در موارد نوزادان تست لختگی را هر ۲ ساعت و اگر ثبات برقرار نبود هر ۲۰ الی ۳۰ دقیقه تست را تکرار نمائید.
PTT می تواند بجای ACT کنترل شود ؛ سطح آن بایستی در ۶۰ الی ۹۰ ثانیه باقی بماند.
گام چهارم : اگر پلاکت کمتر از ۵۰۰۰۰ باشند ، دوز را بکاهید . در این مورد PTT راهنمای بهتری خواهد بود .
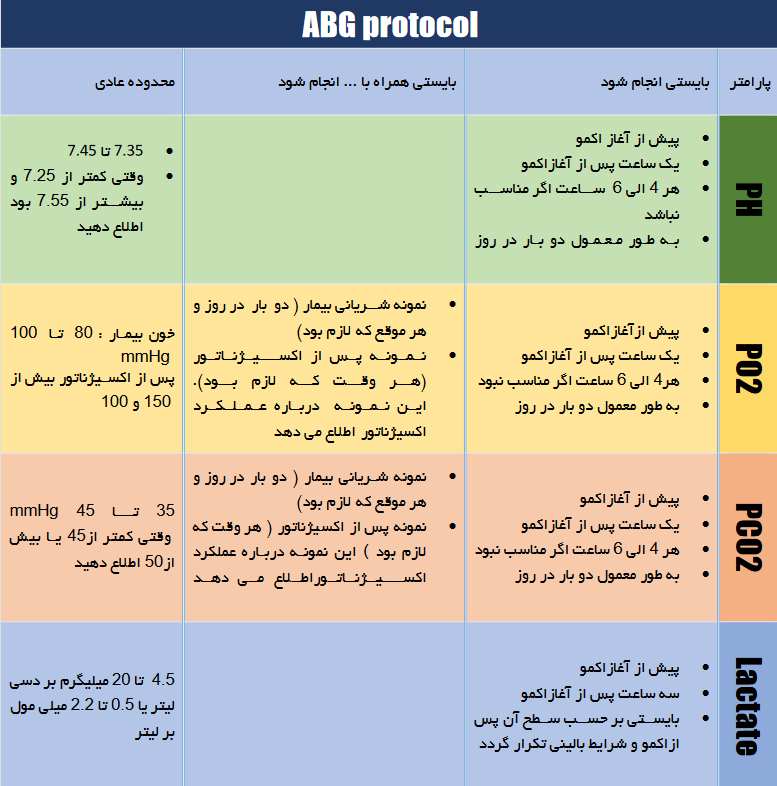
پروتکلABG :
چک ABG به طور متناوب هر ۱ تا ۲ ساعت در اکمو انجام می گیرد . ما پارامتر های زیر را کنترل می کنیم :
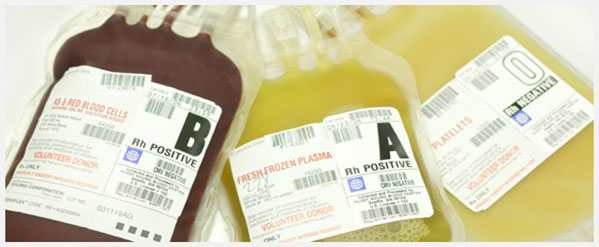
پروتکل تزریق فرآورده های خونی :
رویه های تزریق فرآورده های خونی به قرار زیر هستند :
- خون کامل
- پلاکت
- گلبول قرمز تغلیظ شده
- کرایوپرسیپیتیت
- FFP
- آنتی ترومبین ۳
Whole blood
- بایستی به هنگام خونریزی ممتد و زمانی که شما قصد تزریق گلبول قرمز بهمراه حجم و فاکتور های انعقادی را دارید ، به بیمار تزریق گردد.
- بایستی در طول۱ تا ۲ ساعت و از طریق ورید های مرکزی به بیمار داده شود
- هموگلوبین خون ، فاکتور های انعقاد و حجم خون را افزایش می دهد
- سازگارسازی دوز (Adjustment) هپارین لازم نیست
Pletelet
- در صورت عدم خونریزی بایستی با شمار پلاکت کمتر از ۵۰۰۰۰ و در صورت خونریزی با شمار کمتر از ۱۰۰۰۰۰ نزریق صورت گیرد.
- بایستی در مدت ۲۰ دقیقه و از طریق ورید مرکزی به بیمار داده شود.
- سازگارسازی دوز (Adjustment) هپارین الزامی است . پیش از آنکه پلاکت تزریق گردد چرا که می تواند زمان لختگی (ACT) را کاهش دهد.
Packed RBC
- بایستی زمانی تزریق گردد کهHCT کمتر از ۳۵ درصد برای اکمو وریدی – شریانی و ۴۰ تا۴۵ درصد برای اکمو وریدی – وریدی باشد
- بایستی در مدت ۱ ساعت و از طریق ورید های مرکزی به بیمار داده شود
- دوز برای کودکان ۱۰میلی لیتر به ازای کیلوگرم است
- ۱ واحد در بزرگسالان HCT را ۳ درصد افزایش می دهد.
Cryopercipitate
- بایستی وقتی فیبرینوژن کم است و یا در موقع آغاز اکمو که رقیق سازی فیبرینوژن رخ می دهد ، تزریق انجام گیرد
- این فرآورده شامل : فیبرینوژن ، فاکتور ۸ ، فاکتور۱۳ ، فیبرونکتین ،vWF ، و مقادیر اندک پروتئین های پلاسماست
- بایستی در مدت ۵ دقیقه و از طریق ورید های مرکزی به بیمار داده شود
- دوز آن ۱۵ میلیلیتر و یا ۱ واحد با ازای۷ تا ۱۰ کیلوگرم وزن بدن است
- فیبرینوژن و برخی فاکتور های انعقادی را افزایش می دهد . ۱ واحد می بایست سطح فیبرینوژن را تا۵۰ میلی لیتر به ازای هر دسی لیتر در یک کودک۱۰ کیلوگرمی افزایش دهد.
- سازگارسازی دوز (Adjustment) هپارین الزامی است .
FFP
- از این ماده برای تصحیح نابهنجاری های انعقادی استفاده می گردد.
- بایستی وقتی که فیبرینوژن بیمار کمتر از۱۰۰ میلیگرم به ازای دسی لیتر یا زمان پروتوترومبین (PT) بیش از ۳۰ ثانیه است و یاINR بیش از ۲ است تزریق صورت گیرد
- بایستی در مدت ۳۰ دقیقه و از طریق ورید های مرکزی به بیمار داده شود .
- دوز ۱۰ تا ۲۰ میلی لیتر به ازای کیلوگرم وزن بدن است و یا۱ واحد به ازای ۲۰ کیلوگرم
- این ماده فعالیت فاکتور های انعقادی را تا۲۰ درصد افزایش می دهد مگر آنکه DIC حضور داشته باشد
- سازگارسازی دوز (Adjustment) هپارین الزامی است ، پیش از دادنFFP بلوس هپارین داده شود .
Antithrombin III
- بایستی وقتی سطح آنتی ترومبین بیمار به زیر۷۰ درصد کاهش می یابد تزریق گردد .
- بایستی از طریق ورید های مرکزی داده شود .
- سطح آنتی ترومبین ۳ را افزایش می دهد و لذا فعالیت هپارین نیز افزایش می یابد ، پس بنابراین مقدار لازم هپارین و متعاقبا ً عوارض ناخواسته آن را کاهش می دهد
- سازگارسازی دوز (Adjustment) هپارین الزامی است و باید دوز هپارین کاهش یابد .
عوارض اکمو :
خونریزی
Bleeding در ۳۰ تا ۵۰ درصد بیمارانی که اکمو دریافت می کنند ، رخ می دهد و این می تواند تهدید کننده حیات بیمار باشد. این پدیده به علت درمان مداوم با دارو های ضد انعقاد و نقض در فعالیت پلاکت رخ می دهد . دقت در تکنیک ، حفظ تعداد پلاکت ها بیش از۵۰۰۰۰ ، و حفظ زمان فعال انعقاد احتمال خونریزی را می کاهد. مداخله در مواردی که خونریزی شدید رخ می دهد ضروری است. خونریزی از زخم های جراحی اغلب نیازمند بررسی سریع با استفاده از الکتروکوتری است . خونریزی به حفره های بدن (مانند شکم ، فضای پلورال) ممکن است نیازمند جراحی برای دستیابی به هموستاز باشد.
اداره خونریزی را بایستی طبق پروتکل انجام داد :
الف ) بیماران فاقد خونریزی :
- پلاکت می بایست در شمار بیش از۵۰۰۰۰ حفظ شوند.
- هدفPTT حدود۵۰ –۷۰ است
ب ) بیماران دارای خونریزی و بیماران پس از جراحی : این مورد شامل بیماران پس از جراحی ، پس از اعمال پروسیجر ، و بیماران با خونریزی خود به خودی است
- نباید هپارین تا زمان رفع خونریزی به مدت ۱۲ تا ۲۴ ساعت (ارزیابی بر اساس مورد فردی) شروع شود
- به سرعت تمامی نقایص المان های لختگی را جایگزین نمائید
- کرایو پریسیپیتیت بدهید تا به فیبریونوژن هدف بیش از ۱٫۵ دست یابید.
- پلاکت تزریق نمائید تا به شمار هدف بیش از ۵۰۰۰۰ دست یابید
- پروتومبینکس(Protombinex) و FFP بدهید تا به هدف INR کمتر از۱٫۳ برسید
- اسیدوز را معکوس کنید و به نورموترمیا دست یافته و آن را ابقا نمائید .
۱- خونریزی کمتر از۱۰۰ میلی لیتر بر ساعت برای ۲ ساعت نخست و کاهش هدر رفت خون با گذشت زمان :
- تست های انعقادی غیر عادی و شمار پلاکت ها را تصحیح نمائید
- ضد فیبرونولیتیک ها را متوقف نمائید (۲ تا ۴ ساعت)
۲- خونریزی بیش از۱۰۰ میلی لیتر بر ساعت برای ۲ ساعت نخست :
- تست های انعقاد غیرعادی و شمار پلاکت ها را تصحیح نمائید
- ضد فیبرونولیتیک ها را ادامه بدهید
- هماتولوژیست را مطلع سازید
۳ – خونریزی بیش از ۴۰۰ میلی لیتر بر ساعت برای ۲ ساعت نخست
- تست های انعقاد غیرعادی و شمار پلاکت ها را تصحیح نمایید
- ضد فیبرونولیتیک ها را ادامه بدهید
- هماتولوژیست را مطلع سازی
- جراح را مطلع سازید
ج ) خونریزی وخیم مداوم : باید مدیریت توسط یک متخصص با تجربه اکمو با مشورت یک هماتولوژیست و متخصصان جراحی مرتبط انجام گیرد
در صورت نیاز به جراحی به غیر از جراحی برای دکانولاسیون بایستی :
- هپارین از ۴ساعت قبل قطع شود
- کمبودهای فاکتورها مشابه بالا اصلاح شود
- ترانس آمین قبل از جراحی شروع شود
- انفوزیون فاکتور فعال VII نتایج متغیری داشته و فقط در موارد منافی حیات زمانی که سایر روش ها مفید نبوده ، کاربرد دارد.
- زمان انعقاد هدف (ACT) معمولا وقتی خونریزی رخ می دهد کاهش می یابد ، تزریق ضد انعقاد کاهش یافته یا متوقف می گردد. برای مثال ،زمان انعقاد هدف ۱۷۰ تا ۱۹۰ ثانیه شود بجای آنکه ۲۱۰ نا ۲۳۰ ثانیه باشد.
د ) خونریزی در محل کانول : این مسئله با استفاده دقیق از تکنیک گشاد نمودن چند مرحله ای ( Sequential dilatation ) به هنگام قرار دادن زیرپوستی کانول و محکم نمودن کانول برای جلوگیری از حرکت آن قابل پیشگیری است . معمولا محل کانول در اثر لغزش جزئی کانول بازگشت شریانی است ، که بخش باریکی از کانول را در نقطه ورود به شریان قرار می دهد. راه های مدیریت این حالت :
- محکم نمودن کانول : تمامی لاین های اکمو بایستی در ۲ جا توسط باندهای چسبنده محکم شوند (توسط گیره های قفل شونده) . محکم نمودن اولیه بر عهده کسی که کانوالسیون انجام میدهد ، است و این وظیفه قابل سپردن به شخص دیگری نیست. تمامی پوشش های لاین های اکمو توسط پرستار تخت اداره می شود.
- محلهای کانول : هر شیفت چک شده (به عنوان بخشی از چک لیست) . پرسنل پزشکی نیز بایستی مکان کانول را با تهیه عکس رادیولوژی چک نمایند. هر تغییر مکانی در یک کانول باید به سرعت به مشاور ICU به منظور مدیریت رخداد ارجاع داده شود.
آمبولی لخته
ترومبوامبولسیون سیستمیک بعلت تشکیل لخته در مسیر خارج بدن ( extracorporeal ) یک عارضه غیرشایع است که می تواند ویرانگر باشد. تأثیر آن در اکمو وریدی – شریانی بیش از اکمو وریدی – وریدی است زیرا تزریق به گردش سیستمی راه می یابد.
- در اغلب بیماران ، استفاده از ضد انعقاد برای دستیابی به زمان لختگی هدف و مشاهده موشکافه مسیر برای عالئم تشکیل لختگی می تواند با موفقیت از بروز آمبولی لختگی جلوگیری کند
- مشاهده مسیر برای عالئم تشکیل لخته شامل بازرسی معمول تمامی اتصالات و مانیتور نمودن گرادیان فشار در عرض اکسیژناتور است. یک تغییر ناگهانی در گرادیان فشار نشان از تشکیل یک لخته دارد.
- لخته های درشت یا در حرکت نیاز به تعویض سریع مسیر یا اجزاء دارد
- مسیرهای پرایم شده معمولا در نزدیکی تخت بیمار نگهداری می شوند ، اگر زمان لختگی هدف به علت خونریزی کاهش یابد، در همین حین خطر تشکیل لخته بالاترین احتمال را دارد. داشتن یک مسیر پرایم شده در دسترس، تعویض اورژانسی را در صورت لزوم تسهیل می کند
عصبی وقوع آسیب عصبی در بیماران مبتلا به نارسایی تنفسی توسط سازمان support llife Extracorporea organization در حدود ۱۰ درصد ثبت شده است. وقوع این مسئله در بیماران دارای نارسایی قلبی و در بیمارانی که اکمو برای آن ها در حین احیاء قلبی ریوی اجرا شده است حدود ۵۰ درصد است.
ایسکمی اندام
 تمامی بیماران تحت اکمو وریدی – شریانی محیطی دارای یک کانول پشتیبان (backflow) هستند که در حین کانول گذاری تعبیه می گردد. اگر بیماری در مرکز دیگری تحت اکمو وریدی شریانی بدون کانول پشتیبان قرار گرفت، باید در اسرع فرصت این مورد انجام گیرد
تمامی بیماران تحت اکمو وریدی – شریانی محیطی دارای یک کانول پشتیبان (backflow) هستند که در حین کانول گذاری تعبیه می گردد. اگر بیماری در مرکز دیگری تحت اکمو وریدی شریانی بدون کانول پشتیبان قرار گرفت، باید در اسرع فرصت این مورد انجام گیرد- وجود پرفیوژن نرمال در اندام تحتانی نباید تیم پزشکی را به نادرستی مطمئن سازد. تمامی بیماران بایستی تحت مطالعه اولتراسونیک عروق در روز نخست و در موقع رخداد خونریزی چشم گیر در محل کانول شریانی قرار گیرند.
Infection چشم گیرترین عارضه به شمار می رود. روش های استریل و کارگذاری کنترل شده (اتاق عمل ، Cathlab) موفقیت بزرگتری را در حذف عفونت در مقایسه با شروع فوریتی اکمو دارد. استفاده بلندمدت از اکمو وریدی – شریانی نیز به خطر بزرگتر عفونت منجر می گردد. این مسئله به حضور طولانی تر کاتتر (سوزن) منسوب می گردد ، به علاوه ، بیمارانی که نیازمند پشتیبانی طولانی تر اکمو وریدی – شریانی هستند، نیز معمولا از بیمارهای بحرانی و عدم عملکرد چند ارگان رنج می برند که آن ها را در خطر بزرگتری از عفونت قرار می دهد.
- مداومت آنتی بیوتیک پروفیلاکسی پس از آغاز اکمو (با یک تزریق وریدی اولیه سفالوسپورین) گزینه ای برای جلوگیری از عفونت های واقع در محل کاتتر است ، اما کاربرد آن در جلوگیری از عفونت سیستمی در ابهام بسرمی برد.
هیپوکسی و هایپروکسی کرونری یا مغزی
- در هنگام اکمو وریدی – شریانی ، خون کاملا اشباع از اکسیژن تزریق شده به شریان فمورال از مسیر اکمو اندام تحتانی و احشای شکمی را پرفیوز می کند. خون خارج شده از قلب به طور انتخابی به سمت قلب ، مغز و اندام های بالایی راهی می شود. در نتیجه اشباع اکسی هموگلوبین خون که به سمت اندام پائینی و احشایی می رود ممکن است با اختالف زیادی بیش از اشباع خون جاری به سمت قلب و مغز باشد. اگر اکسیژندهی تنها از طریق خون اندام پائینی مانیتور شود، هیپوکسی قلبی و مغزی می تواند ناشناخته بماند. برای اجتناب از عوارض ، اشباع اکسی هموگلوبین شریان در اندام فوقانی نیز مانیتور شود. اشباع ضعیف اکسی هموگلوبین شریانی در اندام فوقانی با تزریق کمی خون اشباع به دهلیز راست تصحیح می گردد.
- در معرض هیپوکسی قرار گرفتن نشان از اثرات مخرب بر خونرسانی نوزاد و فعالیت های آنتی اکسیدانی در مردان دارد.
تشخیص هیپوکسی
- SpO2 کمتر از ۸۵ درصد برای اکمو وریدی – وریدی و کمتر از ۹۰ درصد برای اکمو وریدی – شریانی
- PaO2 کمتر از ۵۰ درصد برای اکمو وریدی – وریدی و کمتر از ۶۰ درصد برای اکمو وریدی – شریانی
- کاهش FiO2 در اکمو
- کاهش میزان جریان خون
- در نظر داشتن انفصال (Weaning) اکمو
درمان هیپوکسی (hypoxia) شامل :
- افزایش FiO2
- افزایش میزان جریان
- تصحیح دلیل اصلی
خصوصا در اوایل اکمو برای نارسایی تنفسی ، اگر موجب پنوموتوراکس فشارنده و ایجاد اختلال در همودینامیک نشود نیاز به درناژ ندارد. کاهش بیشتر در ونتیلاسیون ریوی (و افزایش پشتیبانی اکمو) ممکن است نشتی های هوایی را کنترل نموده و یا معکوس نماید و به اجتناب از تعبیه کاتترهای بین دندهای (Chest Tube) بینجامد ، و یا به زمانی که زخم ریه وخامت کمتری دارد موکول نماید.
- بطور مرسوم معمول ترین حالت مرگ تحت اکمو وریدی – وریدی خونریزی بوده است و فضای پلورال معمول ترین محل خونریزی مربوط به کارگذاری کاتتر در فضای بین دنده ای بوده است.
مطلق : نسبی :
درمان ها : سرم تراپی مناسب ، دوپامین با دوز کلیوی ، انفوزین لازیکس (۰٫۱میلی گرم بر کیلوگرم در ساعت) ، تئوفیلین
ترمبوسیتوپنی ناشی از هپارین
HIT ترمبوسیتوپنی ناشی از هپارین می تواند در بیماران گیرنده اکمو رخ دهد . وقتی این عارضه اثبات شد ، تزریق هپارین میبایست با یک ضد انعقاد غیر هپارینی تغییر یابد. ما آرگاتروبان را ترجیح می دهیم زیرا نیمه عمر آن کوتاه بوده و محدوده هدف زمان انعقاد آن مؤثر است .
عملکرد ناصحیح اکسیژناتور
این مشکلات معمولا برای مسیرهای کارکرده (عموما ً بین۲ تا ۳ هفته) که تجمع لخته منجر به فعالسازی سیستم انعقاد و التهاب می شود مرسوم است . مهمترین نشان های آن افزایش D-Dimer و کاهش سطوح فیبرینوژن (کمتر از۲ ) است. بسیار نادر است که اکسیژناتورها عملکرد مناسبی نداشته باشند و دراکسیژندهی کافی خون شکست بخورند ، با این حال، یک Pao2 کمتر از۲۰۰ میلیمتر جیوه پس از اکسیژناتور ((post-oxygenator بایستی شما رابه یک تغییر مسیر هدایت کند. به ندرت ، مسیرها بخاطر لخته زایی سر پمپ و اکسیژناتور به تغییر فوری نیاز پیدا میکنند.
مشکلات کانولها :
- جاگذاری کانول بایستی با دقت انجام گیرد تا از جراحت در رگ ها بخصوص پارگی ورید که می تواند منجر به خونریزی غیرقابل کنترل و چشم گیر شود ، جلوگیری شود . جاگذاری کانول وریدی برای عملکرد موفق پمپ حیاتی است و ارزیابی جاگذاری کانول بوسیله اشعه ایکس (X-ray) می تواند مفید باشد.
- جاگذاری کانول شریانی نیز حیاتی است. اگرکانول در آئورت صعودی قرار گیرد ممکن است افترلود بطنی افزایش یابد که به نوبه خود نارسایی بطن چپ را بدتر می کند . کانول نیز همچنین ممکن است درون دریچه آئورتی در خلاف دیواره بطنی قرار گیرد . این نه تنها منجر به نارسایی دریچه آئورت می شود بلکه پتانسیل پارگی بطن را نیز داراست. اگر کانول شریانی در دیستال آئورت نزولی باشد ، جریان خون شریان کرونری و مغزی ممکن است کاهش یابد . همانند کانول وریدی ، ارزیابی اشعه ایکس برای اطمینان از جاگذاری مناسب کانول شریانی می تواند مفید باشد.
- در اکمو وریدی – وریدی ، این امکان وجود دارد که کانولهای وریدی بسیار نزدیک به یکدیگر قرار گیرند . این منجر به گردش خون از یک ورید به دیگری و همراه است با جریان اندک از قلب به گردش سیستمی . یک مشاهده چشمی می تواند برای تعیین اختلاف رنگ بین خون جاری درون کانول تخلیه وریدی و کانول بازگشت شریانی استفاده شود.
- جریان اکمو بسیار وابسته به حجم خون است و با هیپوولومی ، جاگزینی نادرست کانول ، پنوموتوراکس و پریکاردیال تامپوناد افت می کند. این اتفاق با لرزش و قروچه کردن لوله با افزایش فشار منفی (ایجاد شده توسط پمپ در سیستم وریدی) و نیز افت در خروجی پمپ بروز می کند. مدیریت شامل ، افزایش حجم درون عروق ، رد کردن فشار بالای شکمی ، تامپوناد یا پنوموتوراکس . اگر این روش ها جواب نداد، کاهش اندکی در جریان می تواند مفید باشد و یا یک کانول وریدی اضافی برای افزایش تخلیه وریدی و جریان پمپ تعبیه نمود.
وجود هوای داخل مسیر اکمو تقریبا ۴ درصد از عوارض گزارش شده را تشکیل می دهد. هوای درون مسیر ممکن است از تعدادی از دیگر منابع برآید.
- حباب سازی می تواند به عنوان منبع هوا عمل کند. در این مورد ، اگر طرف وریدی مسیر در حین پرایم کردن بستهشده یا گره بخورد و پمپ فشار منفی زیادی ایجاد کند ، گاز از محلول خارج می شود.
- یک پارگی کوچک در دیواره غشای اکسیژناتور می تواند به آمبولی شدید هوا بینجامد
- به ندرت ، فوق اشباع شدن خون از اکسیژن ممکن است به خارج شدن اکسیژن از خون بینجامد
- انسداد هوایی وریدی یک عارضه مصیبت بار است که نیازمند جداسازی بیمار از حالت اکمو و خارج سازیهوا از مسیر کنونی و یا تعویض کل مسیر دارد.
- یک درجه بالایی از هوشمندی لازم است تا خطر آمبولی هوا به حداقل برسد. تمهیدات کاهش خطر شامل جلوگیری از افزایش PO2 پسا غشا (post-membrane) به بیش از۶۰۰ میلیمتر جیوه و اطمینان حاصلن مودن از نفوذ ناپذیری اتصالات و آب بندی آن هاست. به علاوه ، گیره ها نمی بایست در مسیر قرار گیرند مگر آنکه جریان در پل معکوس گردد.
- اگر حضور هوا تصدیق شد ، کانول شریانی بایستی در نزدیکی بیمار مسدود گردد تا از ورود جلوگیری شود. جریان درون مسیر اکمو نیز بایستی متوقف گردد به علاوه، در موردی که هوا به بیمار وارد شده است ، سر بیمار بایستی به سمت پائین تغییر یابد تا هر هوایی که وارد شده از گردش مغزی خارج شود. شاید هوا از قلب راست با قرار دادن یک لاین مرکزی و مکش از یک ورودی دورتر خارج
گردد.
هشدار جریان پائین
هشدار جریان پائین نشان از افت جریان به زیر محدوده تنظیم شده هشدار دهنده دارد. بایستی یک جستجوی فوری برای دلایل احتمالی انجام داد. جریان توسط تنظیمات بار(load) و سرعت تعیین می گردد. درمان با علل ممکنه تعیین می شود :
- تنظیمات سرعت تغییر یافته است : تنظیمات سرعت پائین آورده شده است اما هشدار دهنده تنظیم نشده است
- ناکافی بودن خروجی از بیمار : جریان بایستی با کاهش تنظیم سرعت پمپ بهبود یابد
- گره خوردگی در لوله ها و پیچ خوردگی : مشکل قابل رؤیتی که با صاف نمودن لوله ها به سرعت مرتفع می شود
- گرفتگی اکسیژناتو ر: کاهش در جریان خون همراه با افزایش اختلاف فشار در اکسیژناتور . با کاهش سرعت بهبود نمی یابد
- خونریزی بیمار : به صورت کاهش خروجی بیمار بروز می کند . هرگاه با اینمواجه شدید ، احتمال خونریزی بیمار (حتی اگر به زودی زود مشهود نبود) را منظور نمائید
- آمبولی هوایی : رؤیت هوا در مسیر و یا سر پمپ
- بالا رفتن فشار خون (تنها دراکمو وریدی – شریانی) : همراه با یک تغییر واضح در فشار ثبت شده خون و حالت بالینی برای مثال بیدار شدن ، سرفه کردن ، کش و قوس بیمار
Pump failure :
در این حالت نارسایی پمپ به هر دلیلی از جمله عملکرد بد پمپ یا قطع برق ، پمپ را باید با یک محور دستی به راه انداخت. دلیل دیگر نارسایی پمپ بازگشت ناکافی وریدی است . دلایل بازگشت وریدی ناکافی شامل هیپوولومیا ، گره خوردگی و یا گرفتگی در مسیر و یا به ندرت تامپوناد قلبی است.
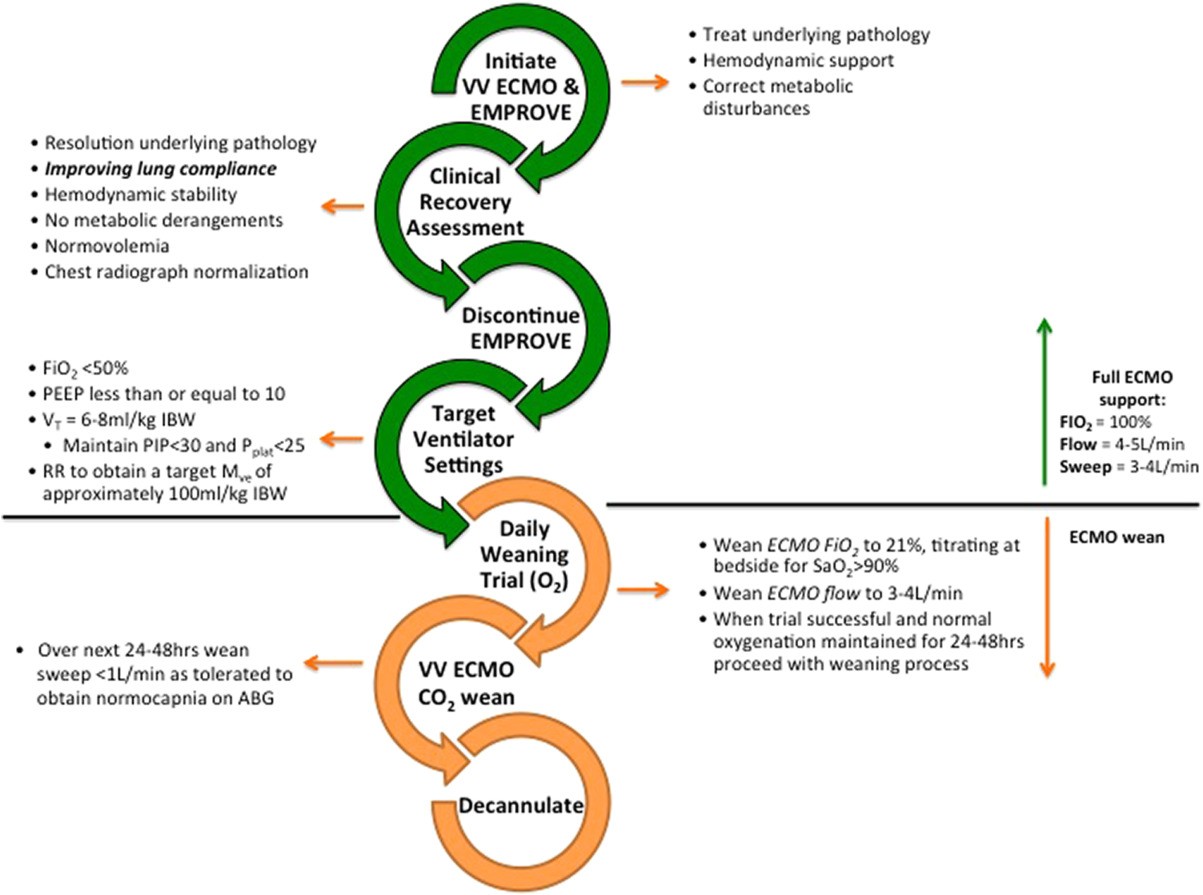
انفصال (Weaning) اکمو :
Weaning فرآیندی است که تدریجا پشتیبانی کلی اکمو از بیمار کاهش می یابد و تلاش می شود تا پشتیبانی مکانیکی قلب و ریه از بیمار جدا گردد و بار ضروری برای بازیابی ریه ها و قلب به بیمار داده شود . انفصال می بایست زمانی در نظر گرفته شود که عملکرد قلب و ریه بیمار بهبود می یابد و شروع به بازیابی حداقل پارامترهای حیاتی می کنند.
Trial off به معنی توقف مقطعی پشتیبانی اکمو پیش از جدا نمودن کانول است. این مهم پس از آن که ۷۰ تا ۸۰ درصد از بار توسط قلب و ریه ها قابل اجرا باشد صورت می گیرد.
معیارها بستگی به اندیکاسیون اکمو دارد. عموما ، معیار انفصال زمانی تعریف می شود که پزشک حس می زند که به هدف مورد قبولش با کمک اکمو دست یافته است ، و مزیت اضافه ای در تداوم اکمو وجود ندارد. وقتی پشتیبانی اکمو به ۴۰ تا ۵۰ درصد می رسد و بقیه بار توسط ارگان های بیمار صورت می پذیرد ، بایستی انفصال را مدنظر قرار داد .

منبع : کتابچه اکسیژندهی غشایی خارج بدن ( اکمو )
نویسنده : دکتر مهدی دلیری ( فوق تخصص جراحی قلب )
- مرکز آموزشی درمانی قلب و عروق شهید رجایی
گردآورنده : صادق دهقانی زاده
 the nursing station ایستگاه پرستاری
the nursing station ایستگاه پرستاری