فرایند حفظ تعادل پویا در میان سولهای مختلف ، بافت ها ، اندام ها و سیستم های بدن انسان بسیار پیچیده و تخصصی می باشد . دو سیستم این ارتباطات حیاتی را تنظیم میکنند : سیستم عصبی و سیستم غدد درون ریز . سیستم عصبی از طریق ایمپالس های عصبی که عضلات اسکلتی ، بافت عضلانی صاف و بافت عضله قلب را کنترل می سازند بین بخش های مختلف بدن ارتباط برقرار می سازد . سیستم غدد درون ریز از طریق آزادسازی هورمون ها در سرتاسر بدن به کنترل و برقراری ارتباط بین قسمت های مختلف بدن می پردازد . تحریک غدد درون ریز منجر به ترشح هورمون هایی به داخل مایعات در گردش بدن می شود . در گردش خون ، این هورمون ها به بافت های هدف خاصی منتقل می شوند و در آنجا اثری را بر جای می گذارند . گیرنده هایی که بر رو یا داخل سلولهای بافت هدف خاص یافت میشوند دارای مولکول هایی میباشند که هورمون را تشخیص داده و به آن متصل می شوند و نوعی پاسخ اختصاصی ایجاد می کند .
پانکراس – pancreas
آناتومی :
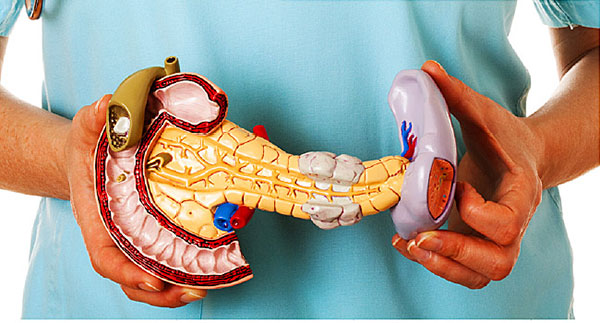
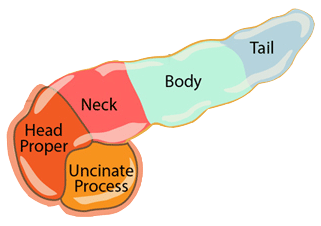
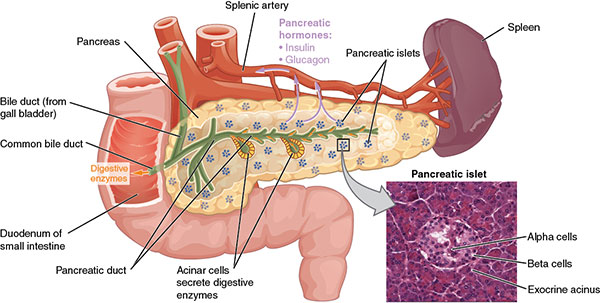
پانکراس ارگانی طویل و مثلثی شکل است و شامل بخش های بخشهای سر ، گردن ، تنه و دم می باشد . سر این ارگان در بخش C شکل دئودنوم قرار می گیرد و قسمت دم آن در پشت و زیر معده تا طحال امتداد پیدا می کند . پانکراس تقریبا ۱۵ سانتی متر ( ۶ اینچ ) طول و ۴ سانتی متر ( ۱٫۵ اینچ ) عرض دارد .
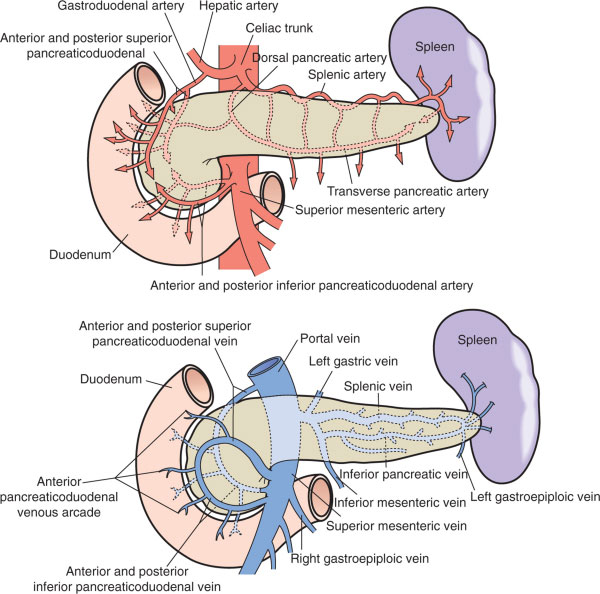
خونرسانی پانکراس :
پانکراس از بخشهای مختلفی خون شریانی را دریافت می کند . سر پانکراس حجم خون خود را از دو شریان آنچه را پانکراتیکودئودنال تامین می کنند : یکی شریان پانکراتیکودئودنال فوقانی است که شاخه ای از شریان مشترک کبدی ( که از تنه سلیاک می آید ) می باشد . دیگری شریان پانکراتیکودئودنال تحتانی است که از شریان مزانتریک منشعب می شود . این دو منبع خون رسانی به یکدیگر ملحق می شوند . گردن ، تنه و دم پانکراس حجم خون خود را از شاخه های متعددی از شریان طحالی ( شاخه دیگر از تنه سلیاک ) دریافت میکنند . درناژ وریدی از طریق ورید هایی که با شریان ها در ارتباط می باشند صورت می گیرد و نهایتاً وریدها به داخل ورید پورت تخلیه می شوند .
- هضمی
- هورمونی
- سلول های برون ریز
- سلول های درون ریز
سلول های برون ریز تخصص یافته در داخل پانکراس آنزیم های گوارشی را به داخل مجرایی که ۳ میلی متر طول دارد و از پانکراس عبور می کند ترشح می سازند . مجرای پانکراسی قبل از اینکه به داخل دئودنوم تخلیه شود به مجرای سیستیک که صفرا را از کبد و کیسه صفرا حمل میکند ملحق میشود . در محلی که دو مجرا به یکدیگر متصل می شوند خطر گیر افتادن سنگ کیسه صفرا در قسمت پاپیلای دوازدهه ( محل اتصال مجرای مشترک به دوازدهه ) بالا می باشد و ممکن است باعث انسداد جریان آنزیم های پانکراسی شود . بخش اعظمی از بافت پانکراس مسئول تولید شیره گوارشی برون ریز است .
پانکراس حاوی سلول های درون ریز تخصص یافته می باشد که هورمون ها را مستقیماً به داخل گردش خون ترشح می سازند . بافت درون ریز کمتر از ۵ درصد از حجم کل پانکراس را به خود اختصاص میدهد . عملکرد هورمون های درون ریز در ادامه مورد بحث قرار خواهد گرفت .
فیزیولوژی :
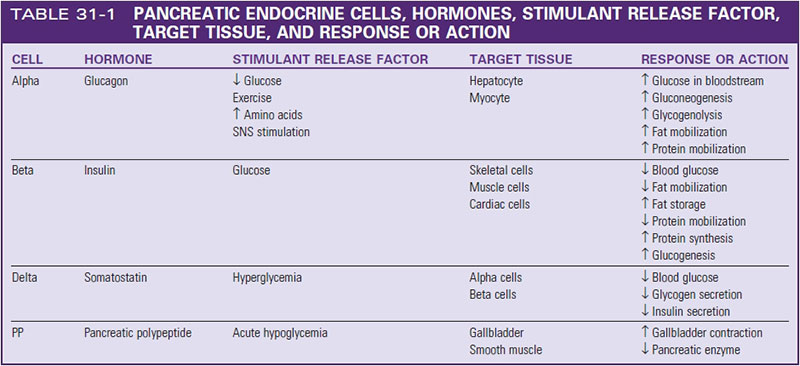
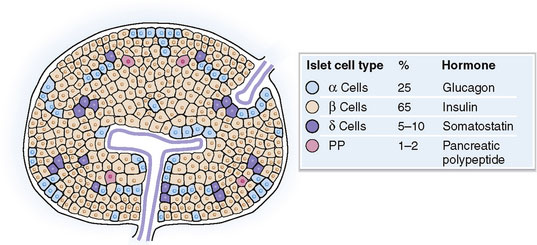
در گذشته اطلاعات در زمینه فیزیولوژی متابولیسم گلوکز منحصرا بر پانکراس متمرکز بوده است . با پیشرفت علم ، مفاهیمی چون پروتئین های منتقل کننده گلوکز سلولی که به عنوان ناقلین گلوکز (GLUTs) شوند و پروتئین های اینکرتین در سیستم معدی-روده ای شناخته شدند . در پانکراس دسته ای از سلول ها که به نظر می رسد تشکیل دهنده جزایر ریزی در میان سلول های برون ریز باشند عهده دار عملکرد های درون ریز پانکراس می باشند . این دست های سلولی به عنوان جزایر لانگرهانس شناخته می شوند و از چهار نوع سلول مختلف تشکیل می شوند : آلفا ، بتا ، دلتا و PP .
- سلول های آلفا ترشح کننده گلوکاگون
- سلول های بتا ترشح کننده انسولین
- سلول های دلتا ترشح کننده سوماتوستاتین
- سلول های PP ترشح کننده هورمون پلی پپتیدی پانکراس
اکثر سلولهایی که جزایر لانگرهانس را تشکیل می دهند سلول های آلفای ترشح کننده گلوکاگون و سلولهای بتای ترشح کننده انسولین می باشند .
گلوکاگون ، انسولین ، سوماتوستاتین و هورمون های پلی پپتیدی به داخل رگ های مجاور آزاد می شوند تا به داخل ورید پورت تخلیه شوند و از این طریق به سلولهای هدف در کبد انتقال یابند . سپس هورمون ها به داخل گردش خون عمومی منتقل می شوند تا به سایر سلولهای هدف برسند .
انسولین :
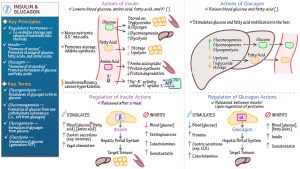
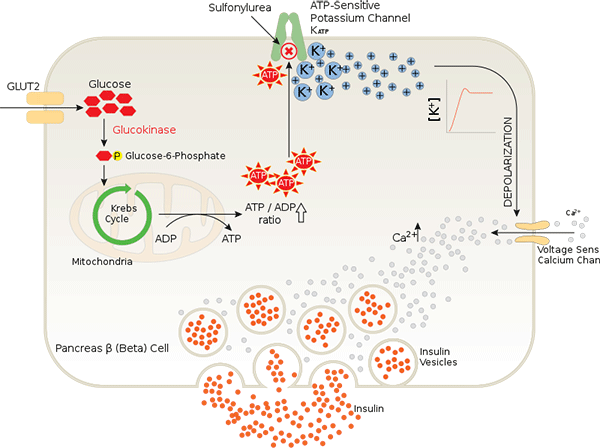
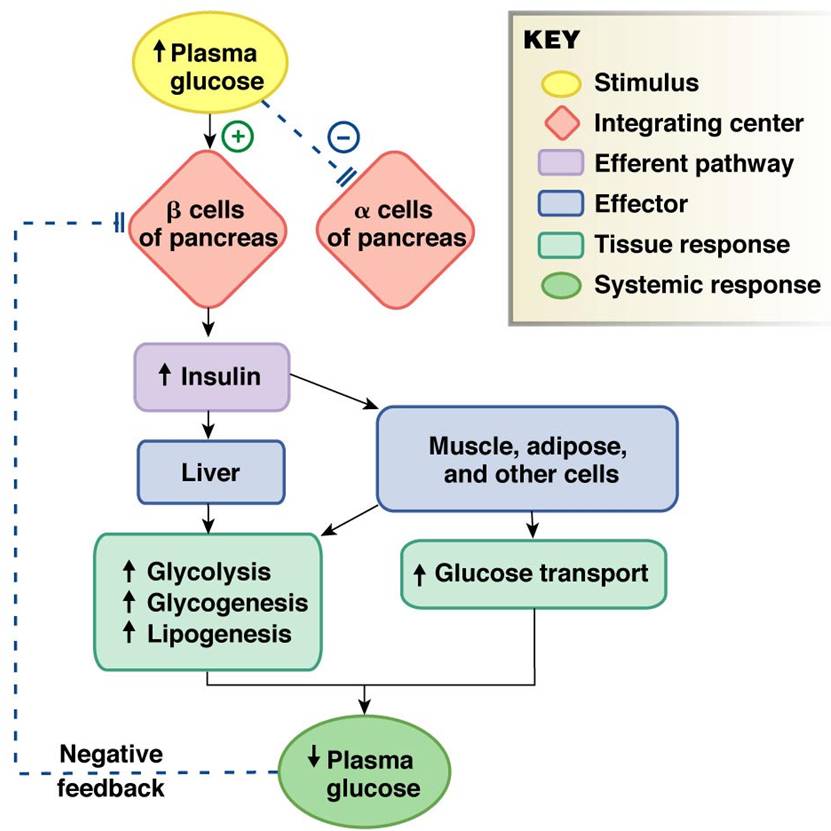
Insulin نوعی هورمون آنابولیک می باشد که توسط سلول های بتا پانکراس تولید می شود . مقادیر بالای گلوکز خون باعث تحریک تولید انسولین می گردد . انسولین تنها هورمون تولید شده در بدن می باشد که به طور مستقیم باعث کاهش سطح قند می شود . انسولین مسئول ذخیره کربوهیدرات ، پروتئین و چربی می باشد . انسولین همچنین انتقال پتاسیم به داخل سلول ها را تقویت می سازد ، جابجایی چربی ها را کاهش می دهد و باعث تحریک سنتز پروتئین میشود . محرک اصلی ترشح انسولین ، افزایش گلوکز سرم می باشد . هرچه افزایش گلوکز خون بیشتر باشد انسولین بیشتری توسط پانکراس سالم تولید می شود . سایر هورمون ها باعث مهار آزادسازی انسولین می شوند .
گلوکز خون :
میزان گلوکز خون به صورت میلی مول بر لیتر گزارش می شود که توسط سیستم واحدهای بین المللی (SI) به عنوان واحد اندازه گیری در سرتاسر دنیا در نظر گرفته شده است . در ایالات متحده ، میزان گلوکز خون بر حسب میلی گرم بر دسی لیتر اندازه گیری می شود . محدوده طبیعی گلوکز خون ۷۰ تا ۱۰۰ میلی گرم بر دسی لیتر (۳٫۹ تا ۵٫۶ میلی مول بر لیتر) می باشد . برای تبدیل واحد میلی مول بر لیتر به میلی گرم بر دسی لیتر ، مقدار میلی مول بر لیتر را در ۱۸ ضرب کنید . جهت تبدیل واحد میلی گرم بر دسی لیتر به میلی مول بر لیتر ، مقدار میلی گرم بر دسی لیتر را بر ۱۸ تقسیم نمایید.
- در بیمارانی که نشانه های دیابت دارند ، تخریب سلولهای بتای پانکراس قبلاً اتفاق افتاده است .
- با تشخیص دیابت نوع یک ، تمامی سلول های بتا فاقد عملکرد می باشند .
- در دیابت نوع دو ، هنگامی که بیمار علائم و نشانه های دیابت را بروز میدهد تقریباً نیمی از سلولهای بتا از قبل تخریب شده اند .
- تخریب سلول های بتا باعث به هم خوردن توانایی تنظیم گلوکز خون می شود .
انتقال دهنده های گلوکز
GLUT سلول های انسانی گلوکز را به وسیله پروتئین های ناقل گلوکز دریافت می کنند . عملکرد این پروتئین ها به واسطه انتشار بافتی و عملکردشان اختصاصی می باشد . در سلول ، گلوکز از طریق منافذ آکوئوس تشکیل شده توسط انتقال دهنده های GLUT از غشای پلاسمایی سلول عبور می کند . تا به حال ۱۴ نوع GLUT شناخته شده اند . شماره GLUT نشان دهنده ترتیبی است که به واسطه آن توالی مولکولی موقعیت بافتی GLUT تعیین شدهاند . عملکرد کلیدی GLUT ها با جزئیات بیشتر در ادامه بحث قرار خواهد گرفت .
GLUT1 و GLUT3 : سیستم عصبی مرکزی به طور آزادانه و از طریق GLUT1 و GLUT3 نسبت به گلوکز نفوذپذیر می باشد . سیستم عصبی مرکزی (CNS) برای انتقال گلوکز در سرتاسر غشای سلول عصبی از انسولین استفاده نمی کند . مغز و سایر سلول های سیستم عصبی مرکزی به یک منبع دائمی گلوکز نیاز دارد تا حداقل میزان گلوکز و گلوکاگون ذخیره ای را حفظ نمایند .
GLUT2 : پروتئینهای GLUT2 در تشخیص گلوکز دخالت دارند و ورود سریع گلوکز به داخل سلول های اختصاصی چون بتای پانکراس و سلول های تشخیص دهنده گلوکز واقع در ناحیه ورید کبدی-پورتی را تسهیل می بخشند . در روده و در حضور یک وعده غذایی حاوی مقادیر بالای گلوکز ، پروتئین های GLUT2 ممکن است به سر اپیکال سلول منتقل شوند تا از این طریق افزایش جذب گلوکز از روده به گردش خون شود .
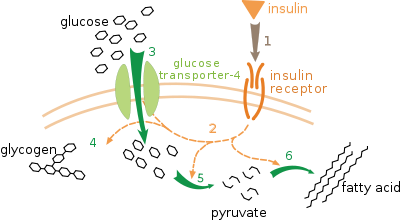
GLUT4 : پروتئین GLUT4 پاسخ دهنده به انسولین ، نقش اساسی در نحوه انتقال گلوکز از گردش خون به داخل سلول دارد . پس از یک وعده غذایی ، مقادیر قند و اسیدهای آمینه در گردش خون افزایش می یابد . به دنبال این افزایش پیامهایی به سلولهای بتای پانکراس ارسال می گردد تا انسولین به داخل گردش خون آزاد کنند . همینطور انسولین در سیستم وریدی به گردش در می آید نوعی گیرنده انسولین بر روی سلول های غشای پلاسمایی ، عضلات محیطی و سلول های چربی را فعال می سازد . این گیرنده شروع به سیگنال رسانی آبشاری و پی در پی در داخل سلول می کند تا فعال شدن GLUT4 که در وزیکول های داخل سلولی ( اندام های ذخیره ای در سلول ) مستقر هستند تا زمانی که نیاز باشد انجام شود .
- GLUT4 از محل ذخیره داخل سلولی به غشای پلاسما و در پاسخ به سیگنال ارسال شده از گیرنده انسولین انتقال می یابد .
- GLUT4 واقع در سطح سلول باعث تسهیل انتقال غیر فعال گلوکز از قسمت با غلظت به داخل عضلات صاف و سلول های چربی می شود . با کمک به این روش ، انتقال گلوکز به داخل سلول های چربی در افراد سالم به میزان ۲۰ تا ۳۰ برابر افزایش می یابد.
- گلوکز انتقال یافته به داخل عضله اسکلتی ، ۸۵ درصد تا ۹۰ درصد از گلوکز خروجی از گردش خون پس از وعده غذایی را تشکیل می دهد .
در وضعیت پایه ( بین وعده های غذایی با سطح گلوکز خون طبیعی ) ، تنها ۴ تا ۱۰ درصد از پروتئین های GLUT4 واقع شده بر روی سطح سلول وجود دارد و ۹۰ درصد بقیه در بخش های ذخیره ای سلول می باشند . در طی ۱۰ تا ۱۵ دقیقه پس از تحریک سلول های عضلانی با انسولین ، تعداد پروتئین های GLUT4 در سطح سلول با جا به جایی سریعی که از داخل و سطح سلول اتفاق می افتد ، دو برابر میشود . بین وعده های غذایی ، کبد به طور طبیعی برونده کافی گلوکز را فراهم می آورد تا مقادیر گلوکز در گردش خون در محدوده طبیعی حفظ شود .
GLUT5 : نقش پروتئین های GLUT5 جذب فروکتوز است که بر روی سطح اپتیکال سلول های روده ای یافت می شوند . به دلیل سطوح بالای فروکتوز در بسیاری از غذاهای فرآوری شده در دنیای مدرن امروز و ارتباطات بین غذاهای با پروتئین بالا و چاقی ، GLUT5 از اهمیت بالایی برخوردار است .
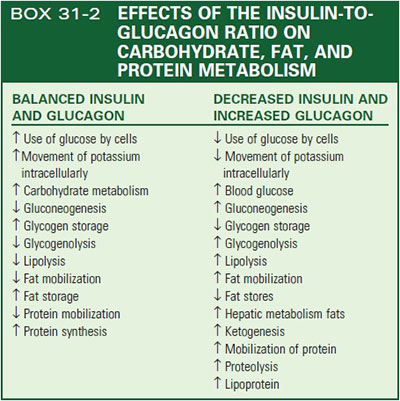
آنابولیسم کربوهیدرات : گلوکز در حضور انسولین موثره و از طریق ناقل گلوکز ۴ (GLUT4) به سلول های اسکلتی ، قلبی و چربی وارد می شود تا برای ذخیره انرژی مورد استفاده قرار گیرد . جابجایی گلوکز از جریان خون به بخش داخل سلولی باعث کاهش غلظت گلوکز موجود در جریان خون شده و به حفظ اسمولاریتی خون کمک می کند . به طور همزمان ، گلوکز در سلول نیز به عنوان منبع انرژی اصلی در دسترس می باشد . پس از آن گلوکز اضافی به شکل گلیکوژن در کبد و سلول های عضلانی به منظور استفاده به عنوان سوخت ذخیره می گردد . در عضله اسکلتی ، ۹۰ درصد از گلوکز در سلول به گلیکوژن تبدیل می شود تا برای مدت طولانی تری ذخیره شود . آزادسازی گلیکوژن باعث حفاظت در برابر اثرات هایپوگلیسمی می شود . با این حال با تشخیص دیابت نوع یک ، میزان گلیکوژن پس از یک وعده غذایی (هایپرگلیسمی پس از وعده غذایی) بیش از حد زیاد می باشد و در وضعیت های هیپوگلیسمیک ناکافی می باشد . مطالعات جدید حاکی از آن است که اختلال هر دو نوع سلول بتا و آلفا در دیابت دخیل می باشد .
آنابولیسم چربی : مقادیر کافی و موثر انسولین برای متابولیسم لیپید ها ضروری می باشد . دیابت نوع دو غالبا با دیس لیپیدمی و افزایش خطر بیماری تصلب شرایین قلبی (Atherosclerosis) در ارتباط باشد . دیابت نوع ۲ با تولید بیش از حد لیپوپروتئین ها درشت غنی از تری گلیسرید و با دانسیته خیلی کم و کاهش مقادیر لیپوپروتئین های با دانسیته بالا مشخص می شود . اختلال در متابولیسم کربوهیدرات و چربی همچنین با سندروم متابولیک که زمینهساز بیماری دیابت و بیماری های قلبی-عروقی می باشد مرتبط است.
حفظ پروتئین : انسولین و GLUT ها ، هر دو انتقال گلوکز در سرتاسر دیواره سلولی را تسهیل می بخشد . در صورت در دسترس بودن (کربوهیدرات) به عنوان منبع سوختی بدن ، از پروتئین به عنوان منبع انرژی استفاده نمی شود . بنابراین پروتئین برای مصارف دیگر یعنی سنتز پروتئین های ضروری و انتقال آمینو اسید به داخل سلول مورد استفاده قرار می گیرد . متابولیسم پروتئین از در دسترس بودن مقادیر کافی ذخایر انسولین نیز سود میبرد . تنها در هایپرگلیسمی حاد به دنبال کتواسیدوز دیابتی یا حالت گرسنگی ، بدن از پروتئین به عنوان منبع انرژی استفاده می کند .
گلوکاگون :
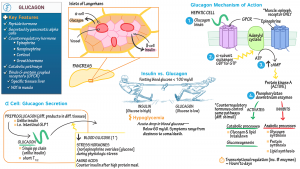
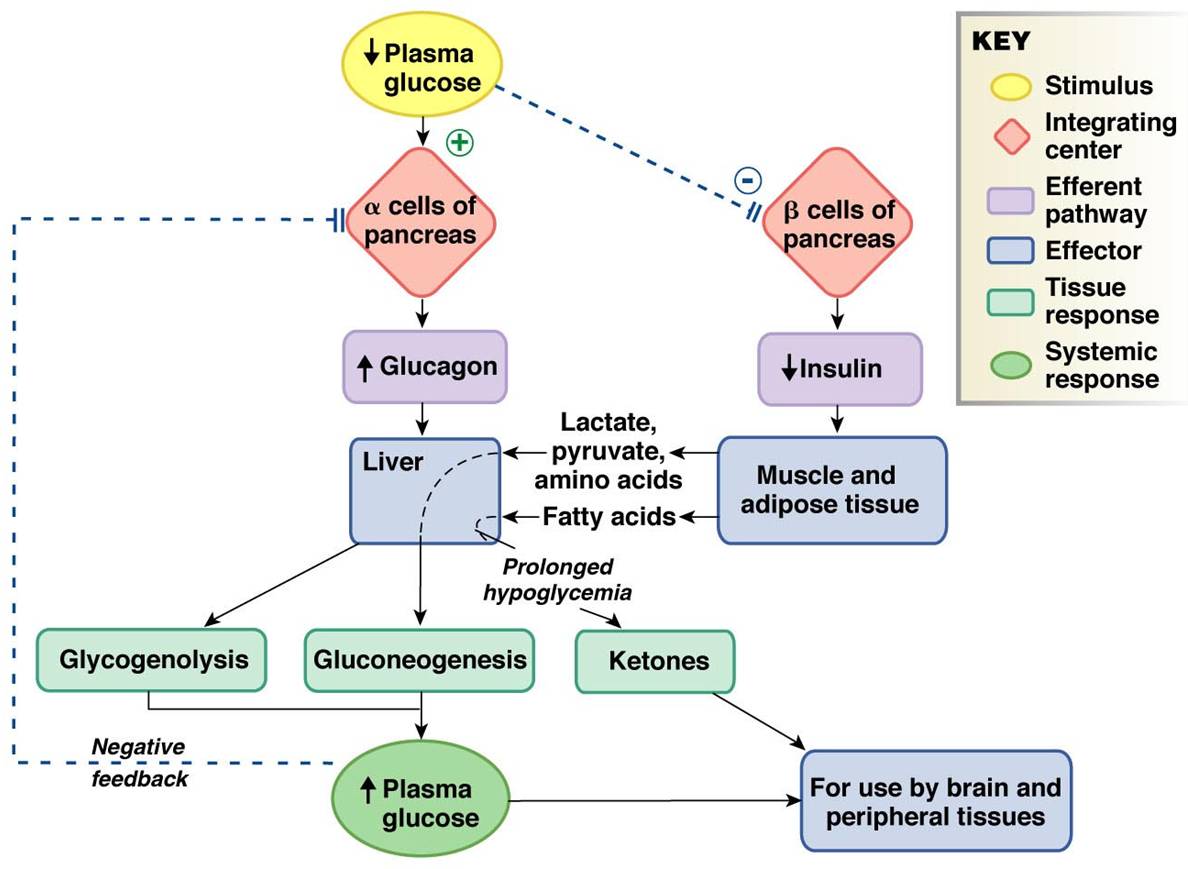
Glucagon که توسط سلولهای آلفای پانکراس سنتز می شود اثری عکس اثر انسولین دارد . گلوکاگون در طول شرایط هیپوگلیسمیک ترشح می شود تا آزادسازی گلوکز کبدی را تحریک نماید . از آنجایی که گلوکاگون با انسولین مداخله میکند و باعث افزایش سطوح قند خون می شود به عنوان یک هورمون گلوکونئوژنیک قوی در نظر گرفته می شود . از طریق گلوکونئوژنز (gluconeogenesis) ، گلوکاگون میتواند در صورت نیاز از منابع غیر کربوهیدراتی نظیر چربی و پروتئین گلوکز را تولید نماید . آزاد سازی گلوکاگون ، از پانکراس به دنبال پایین بودن گلوکز خون ، گرسنگی ، فعالیت یا تحریک سیستم عصبی سمپاتیک (SNS) اتفاق میافتد . آزادسازی گلوکاگون ، از بدن در برابر عوارض هایپوگلایسمی محافظت می کند .
- جهت دستیابی به ذخایر انرژی کوتاه مدت ، گلوکاگون آزادسازی گلیکوژن ذخیره شده در کبد و سلول های عضلانی را تحریک می سازد . از طریق فرایندی تحت عنوان گلیکوژنولیز (glycogenolysis) ، گلیکوژن ذخیره شده در کبد به فرمی از گلوکز که میتواند توسط سلول ها مورد استفاده قرار بگیرد تبدیل می شود.
- برای نیازهای انرژی طولانی مدت ، گلوکاگون از طریق فرآیند پیچیده تر گلوکونئوژنز (gluconeogenesis) ، آزاد سازی گلوکز را تحریک می سازد . در گلوکونئوژنز ، ذرات چربی و پروتئین شکسته می شوند و سپس به گلوکز تبدیل می گردد .
- در بدن فرد سالم ، از طریق نسبت انسولین به گلوکاگون سطح نرمال گلوکز خون حفظ می شود .
- زمانی که سطح گلوکز خون بالا باشد ، انسولین آزاد میشود و گلوکاگون مهار می گردد .
- زمانی که میزان گلوکز خون پایین باشد گلوکاگون به جای انسولین آزاد می شود تا سطح گلوکز خون را افزایش دهد .
- مغز ذخیره گلوکز خیلی محدودی دارد و از این جهت آزادسازی گلوکاگون برای حفظ مغز در مقابل اثرات هایپوگیسمی ضرورت پیدا میکند .
سوماتوستاتین :
Somatostatin توسط سلولهای دلتا پانکراس تولید میشود . سوماتوستاتین باعث کاهش ترشح گلوکاگون می شود . در مقادیر بالا ، سوماتوستاتین باعث کاهش ترشح انسولین نیز می گردد . هایپرگلیسمی فعالیت سلولهای دلتای پانکراس را تحریک می سازد . به نظر می رسد با آزادسازی انسولین ، سوماتوستاتین قادر خواهد بود فعالیت سلولهای بتای پانکراس را کنترل نماید . سوماتوستاتین می توانند در تنظیم آزادسازی گلوکز پس از وعده غذایی به داخل سلول نیز نقش داشته باشد .
پلی پپتید پانکراسی :
PP سلولهای PP واقع در جزایر لانگرهانس هورمون پلی پپتیدی پانکراسی را سنتز می نمایند . این هورمون پس از یک وعده قضایی آزاد می شود و برای چندین ساعت به مقدار آن بالا می ماند که این دلالت بر نقش آن در فرآیند هضم نیز دارد . هورمون پلی پانکراس در حرکات سیستم معدی – روده و عملکرد کیسه صفرا اثر گذار می باشد . سایر عملکردهای آن هنوز شناخته نشدهاند .
اینکرتین ها :
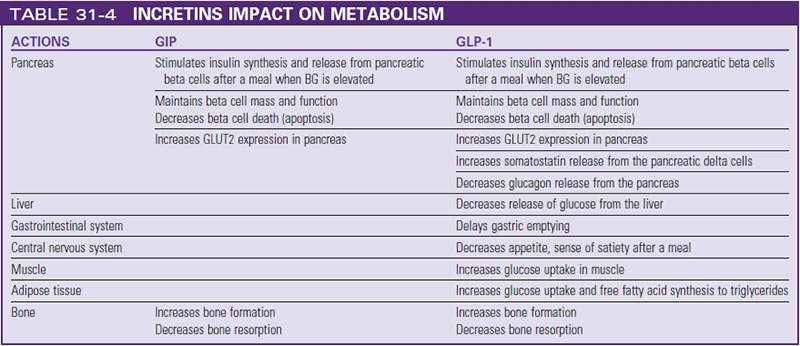
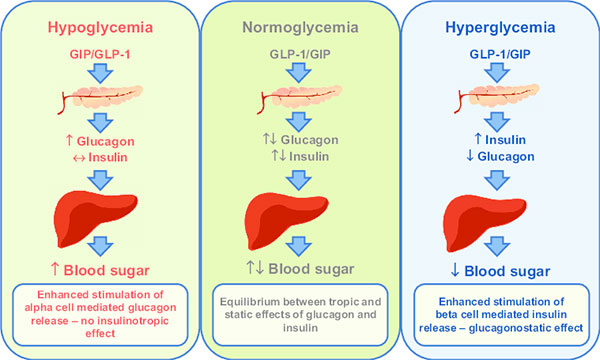
Incretins اینکرتین ها که هورمونهای ترشح شده از مجاری معدی – روده ای پس از وعده غذایی می باشند ، تولید انسولین از سلولهای بتای پانکراس را افزایش می دهند . دو نوع اینکرتین وجود دارند که از نظر بالینی از اهمیت خاصی برخوردارند :
- پپتید ۱ شبیه به گلوکاگون (GLP-1)
- پلی پپتید انسولینوتروپیک وابسته به گلوکز (GLP)
- دانش فیزیولوژی اینکرتین ها به کشف داروهای جدیدی که سطح گلوکز خون پس از غذا را در دیابت نوع دو کاهش می دهند ، کمک نموده است .
- به دلیل آزادسازی اینکرتین های روده ای ، پس از مصرف گلوکز از راه دهان در مقایسه با دریافت همین میزان گلوکز از راه وریدی انسولین بیشتری آزاد می شود.
- افزایش ترشح انسولین به دنبال تحریک اینکرتین ها ، میتواند ۷۰ درصد از پاسخ انسولینی را به خود اختصاص دهد که بستگی به حجم وعده غذایی دارد .
- اثر اینکرتینی در بیماران با دیابت نوع دو محترم می باشد .
- پپتید ۱ ، شبیه به گلوکاگون :
- پلی پپتید انسولینوتروپیک وابسته به گلوکز :
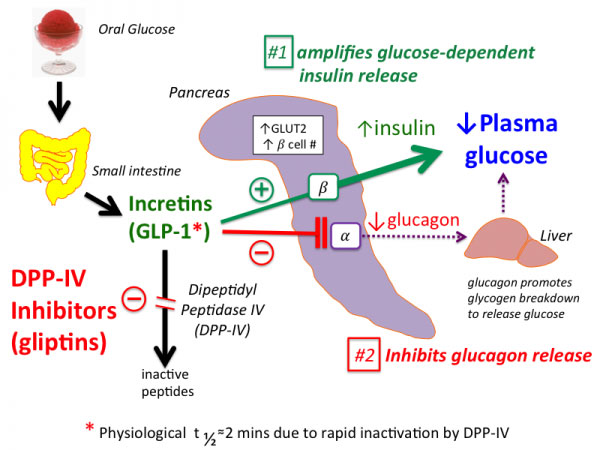
GLP-1 نیز نوعی اینکرتین می باشد که تحت عنوان ” هورمون روده ای ” توصیف می شود . GLP-1 در سلولهای L اندوکرین رودهای واقع در ایلئوم و کولون سنتز شده و آزاد می شود . در صورت بالا بودن میزان گلوکز ، GLP-1 آزادسازی انسولین از پانکراس را تحریک و آزادسازی گلوکاگون از کبد را مهار می سازد . GLP-1 نیمه عمر کوتاه کمتر از ۲ دقیقه دارد به این دلیل که سریعاً توسط آنزیم دی پپتیدیل پپتیداز۴ (DPP-4) تجزیه می شود . گلیپتین ها داروهایی هستند که جهت مهار آنزیم DPP-4 ساخته شدهاند و غیرفعال شدن GLP-1 درون زاد را کند سازند تا از این طریق بالا رفتن سطح قند پس از غذا را کاهش دهند .
GLP-1 اثرات مفید دیگری نظیر کاهش تخلیه معده ای و حس سیری ( تست پر بودن ) پس از وعده غذایی را ایجاد می کند . زمانی که سطح قند خون در محدوده طبیعی باشد GLP-1 آزادسازی سوماتوستاتین از سلول های دلتای پانکراس و گلوکاگون از کبد را مهار می سازد .
منبع : ۲۰۱۸ Critical Care Nursing : Diagnosis and Management

نویسنده :
- Linda D. Urden
- Kathleen M. Stacy
- Mary E. Lough
مترجمین :
- افشین خزایی
- زهرا ماندگاری
- فاطمه یوسفی
تهیه و تنظیم : صادق دهقانی زاده
 the nursing station ایستگاه پرستاری
the nursing station ایستگاه پرستاری